Fosfor oksiklorida (POCl3) merupakan senyawa kimia yang digunakan dalam berbagai proses industri. Bereaksi dengan air membentuk asam fosfat dan asam klorida.
| Nama IUPAC | Fosfor oksiklorida |
| Formula molekul | POCl3 |
| nomor CAS | 10025-87-3 |
| Sinonim | Fosforil klorida, fosforil triklorida, fosfor triklorida |
| Di ChI | InChI=1S/Cl3OP/c1-4(2)3 |
Sifat fosfor oksiklorida
Formula Fosfor Oksiklorida
Rumus kimia fosforil klorida adalah POCl3. Terdiri dari satu atom fosfor (P) yang dilambangkan dengan P, dan tiga atom klor (Cl) yang dilambangkan dengan Cl. Rumusnya menunjukkan perbandingan masing-masing unsur yang ada dalam senyawa.
Massa Molar Fosfor Oksiklorida
Massa molar fosforil klorida dapat dihitung dengan menjumlahkan massa atom unsur penyusunnya. Fosfor memiliki massa molar 30,97 g/mol, sedangkan klor memiliki massa molar 35,45 g/mol. Mengalikan massa molar klorin dengan 3 dan menambahkan massa molar fosfor menghasilkan massa molar total sekitar 153,33 g/mol untuk fosforil klorida.
Titik didih fosfor oksiklorida
Fosforil klorida memiliki titik didih sekitar 105,5°C. Suhu ini mewakili titik di mana senyawa cair berubah menjadi gas di bawah tekanan atmosfer standar. Titik didih merupakan karakteristik penting yang mempengaruhi penanganan dan penerapan fosforil klorida.
Titik lebur fosfor oksiklorida
Titik leleh fosforil klorida kira-kira -112,5°C. Artinya suhu di mana senyawa padat berubah wujud menjadi cair. Titik lebur merupakan parameter penting untuk pertimbangan penyimpanan dan transportasi.
Kepadatan fosfor oksiklorida g/mL
Kepadatan fosforil klorida kira-kira 1,65 g/mL. Massa jenis mengacu pada jumlah massa per satuan volume suatu zat. Kepadatan yang lebih tinggi menunjukkan konsentrasi partikel yang lebih besar dalam volume tertentu.
Berat Molekul Fosfor Oksiklorida
Berat molekul fosforil klorida dihitung dengan menjumlahkan massa atom unsur penyusunnya. Berat molekul fosfor kira-kira 30,97 g/mol, sedangkan klor memiliki berat molekul 35,45 g/mol. Menambahkan massa tertimbang menghasilkan perkiraan berat molekul 153,33 g/mol untuk fosforil klorida.
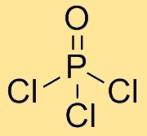
Struktur fosfor oksiklorida
Fosforil klorida memiliki struktur molekul dimana satu atom fosfor terikat pada tiga atom klor dan satu atom oksigen. Atom klor tersusun secara simetris mengelilingi atom fosfor pusat, dengan atom oksigen juga terikat pada atom fosfor. Susunan ini membentuk geometri tetrahedral.
Kelarutan fosfor oksiklorida
Fosforil klorida sulit larut dalam air tetapi mudah larut dalam pelarut organik seperti benzena, karbon tetraklorida, dan kloroform. Perilaku kelarutannya disebabkan oleh sifat polar molekul dan adanya atom elektronegatif seperti oksigen dan klor.
| Penampilan | Cairan tidak berwarna |
| Berat jenis | 1,645 gram/ml |
| Warna | Tanpa warna |
| Bau | hektar |
| Masa molar | 153,33 g/mol |
| Kepadatan | 1,645 gram/ml |
| Titik fusi | -112,5°C |
| Titik didih | 105,5°C |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Bereaksi dengan penuh semangat |
| Kelarutan | Larut dalam pelarut organik seperti benzena, karbon tetraklorida dan kloroform |
| Tekanan uap | 11 mmHg pada 20°C |
| Kepadatan uap | 5.29 (Udara = 1) |
| pKa | Tak dapat diterapkan |
| pH | Tak dapat diterapkan |
Keamanan dan bahaya fosfor oksiklorida
Fosforil klorida menimbulkan bahaya keselamatan dan memerlukan penanganan yang hati-hati. Ini bersifat korosif terhadap kulit, mata dan sistem pernafasan. Kontak dapat menyebabkan luka bakar parah dan kerusakan mata. Menghirup asap atau uapnya dapat mengiritasi saluran pernafasan. Peralatan pelindung diri yang sesuai, seperti sarung tangan dan kacamata, harus dipakai saat bekerja dengan senyawa ini. Itu harus disimpan di tempat yang berventilasi baik, jauh dari sumber api. Jika terpapar, perhatian medis segera diperlukan. Selain itu, harus ditangani di bawah lemari asam untuk menghindari pelepasan uap beracun.
| Simbol bahaya | Korosif, Bahaya |
| Deskripsi Keamanan | Korosif. Menyebabkan luka bakar kulit yang parah dan kerusakan mata. Mungkin berbahaya jika terhirup atau tertelan. Hindari kontak dan penghirupan. |
| Nomor identifikasi PBB | Sebuah tahun 1810 |
| kode HS | 2812.10.00 |
| Kelas bahaya | Kelas 8 (zat korosif) |
| Kelompok pengepakan | Kelompok pengepakan III (bahaya kecil) |
| Toksisitas | Fosforil klorida bersifat racun dan dapat menyebabkan efek kesehatan yang serius. |
Metode sintesis fosfor oksiklorida
Fosforil klorida dapat disintesis dengan berbagai metode. Metode yang umum melibatkan reaksi antara fosfor triklorida (PCl3) dan oksigen (O2). Dalam proses ini, PCl3 dipanaskan dengan adanya oksigen berlebih untuk membentuk fosforil klorida. Reaksinya bersifat eksotermik dan biasanya terjadi dalam lingkungan terkendali, seperti bejana reaktor.
Metode sintesis lain melibatkan reaksi antara fosfor pentoksida (P2O5) dan fosfor triklorida. P2O5 bertindak sebagai zat dehidrasi, dan bila digabungkan dengan PCl3 , ia membentuk fosforil klorida.
Selain itu, fosforil klorida dapat disintesis melalui reaksi fosfor tribromida (PBr3) dan fosfor pentoksida. Reaksi ini mengarah pada pembentukan fosforil klorida dan fosfor pentabromida.
Selain itu, klorinasi langsung fosfor juga dapat menghasilkan fosforil klorida. Dalam proses ini, gas klor melewati fosfor yang dipanaskan, menghasilkan pembentukan fosforil klorida.
Penting untuk dicatat bahwa metode sintetik ini harus dilakukan dengan hati-hati karena reaktivitas dan sifat berbahaya dari senyawa yang terlibat. Protokol keselamatan yang tepat, termasuk penggunaan peralatan pelindung dan kondisi reaksi terkendali, harus diikuti untuk memastikan penanganan dan sintesis fosforil klorida yang aman.
Kegunaan Fosfor Oksiklorida
Fosforil klorida menemukan berbagai aplikasi di berbagai industri karena sifatnya yang unik. Berikut beberapa kegunaan umum:
- Sintesis kimia: Kimia organik banyak menggunakan fosforil klorida sebagai reagen serbaguna untuk menghasilkan berbagai senyawa, termasuk asam fosfonat, ester, dan Amida.
- Bahan kimia pertanian: Sintesis pestisida dan herbisida dalam perlindungan tanaman dan pengendalian hama berkaitan dengan fosforil klorida sebagai bahan utama, yang memainkan peran penting.
- Industri farmasi: Pembuatan zat antara farmasi dan bahan aktif farmasi (API) menggunakan fosforil klorida, memfasilitasi sintesis obat-obatan penting seperti obat antimalaria dan antiinflamasi.
- Industri polimer: Dalam produksi polimer, fosforil klorida bertindak sebagai katalis dan zat klorinasi, berkontribusi pada sintesis aditif tahan api yang meningkatkan ketahanan bahan terhadap api.
- Industri pewarna dan pigmen: Fosforil klorida digunakan dalam produksi pewarna dan pigmen, khususnya dalam pembuatan kloroalkil fosfonat, senyawa penting untuk pengembangan pewarna yang digunakan dalam tekstil, tinta dan pelapis.
- Reagen Laboratorium: Berbagai prosedur laboratorium menggunakan fosforil klorida sebagai reagen, termasuk konversi alkohol menjadi alkil klorida dan pembuatan zat fosforilasi.
- Pengolahan Air: Proses pengolahan air menggunakan fosforil klorida sebagai zat pengasaman dan desinfektan untuk mengontrol tingkat pH dan menghilangkan kotoran.
- Penghambat Api: Fosforil klorida berperan dalam produksi bahan tahan api, meningkatkan sifat keselamatan kebakaran pada tekstil, plastik, dan bahan konstruksi.
Aplikasi yang beragam ini menunjukkan pentingnya fosforil klorida di banyak sektor industri, menyoroti peran pentingnya dalam sintesis kimia, pertanian, farmasi, dan ilmu material.
Pertanyaan
Q: Apa geometri molekul POCl3?
A: Geometri molekul POCl3 adalah trigonal piramidal.
Q: Apa alkena utama yang terbentuk ketika senyawa A didehidrasi dengan POCl3 dan piridin?
A: Alkena utama yang terbentuk selama dehidrasi senyawa A dengan POCl3 dan piridin bergantung pada struktur spesifik senyawa A.
Q: Apakah POCl3 polar atau non-polar
A: POCl3 adalah molekul polar karena adanya ikatan polar dan bentuk molekul yang asimetris.
Q: Berapa banyak gas POCl3 yang dapat dihasilkan?
A: Volume gas POCl3 yang dihasilkan bergantung pada jumlah reaktan dan kondisi spesifik reaksi.
Q: Berapa mol POCl3 dalam 10,0 gram POCl3?
A: Terdapat sekitar 0,082 mol POCl3 dalam 10,0 gram POCl3.
Q: Bagaimana geometri pasangan elektron P pada POCl3?
A: Geometri pasangan elektron untuk P dalam POCl3 adalah tetrahedral.
Q: Apakah POCl3 mempunyai momen dipol?
J: Ya, POCl3 memiliki momen dipol karena adanya ikatan polar dan geometri molekulnya.
Q: Apakah POCl3 mempunyai resonansi?
J: Tidak, POCl3 tidak menunjukkan resonansi karena tidak ada elektron yang terdelokalisasi atau struktur resonansi ganda.
Q: Bagaimana geometri domain elektronik di sekitar atom oksigen pada POCl3?
A: Geometri domain elektronik di sekitar atom oksigen pada POCl3 adalah trigonal piramidal.
Q: Berapa volume H3PO4 yang akan terbentuk jika 72,3 mililiter POCl3 bereaksi sempurna?
J: Volume H3PO4 yang terbentuk ketika 72,3 mililiter POCl3 bereaksi sepenuhnya bergantung pada stoikiometri reaksi dan tidak dapat ditentukan hanya berdasarkan informasi yang diberikan.
