Ethylene, juga dikenal sebagai ethylene, adalah gas yang tidak berwarna dan mudah terbakar dengan bau yang manis. Ini adalah bagian penting dari industri kimia, digunakan dalam produksi plastik, pelarut dan bahan kimia lainnya.
| Nama IUPAC | etena |
| Formula molekul | C2H4 |
| nomor CAS | 74-85-1 |
| Sinonim | Etilena, Etena (salah), Gas pengoles, Elayl, 1,2-Dihidrogen etilen |
| Di ChI | InChI=1S/C2H4/c1-2/h1-2H2 |
Rumus etilen
Rumus kimia etena adalah C2H4. Ini mewakili jumlah dan jenis atom yang ada dalam molekul etena. Rumusnya digunakan dalam reaksi kimia dan perhitungan yang melibatkan etilen, seperti menentukan stoikiometri suatu reaksi atau jumlah etilen yang diperlukan untuk proses industri tertentu.
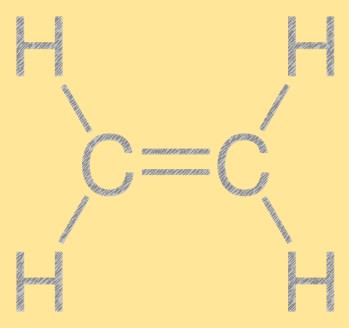
Struktur etilen
Etilena memiliki struktur linier sederhana, dengan dua atom karbon dihubungkan melalui ikatan rangkap dan empat atom hidrogen terikat pada setiap atom karbon. Ikatan rangkap karbon-karbon bertanggung jawab atas reaktivitas etilen, menjadikannya bahan penyusun yang berguna dalam industri kimia. Molekul mempunyai struktur planar, dengan semua atom terletak pada bidang yang sama.
Massa Molar Etena
Massa molar etena, juga disebut etilen, adalah 28,05 g/mol. Ini adalah molekul organik sederhana yang terdiri dari dua atom karbon dan empat atom hidrogen, yang diwakili oleh rumus kimia C2H4. Massa molar dihitung dengan menjumlahkan massa atom masing-masing atom dalam molekul.
Massa molar merupakan parameter penting dalam reaksi kimia dan perhitungan yang melibatkan etilen. Ini digunakan untuk menentukan jumlah etilen yang dibutuhkan dalam suatu reaksi, serta jumlah produk yang dapat dihasilkan.
Titik didih etilen
Titik didih etena adalah -103,7°C (-154,7°F). Etilena berbentuk gas pada suhu dan tekanan kamar, dan titik didihnya jauh lebih rendah dibandingkan air, sehingga lebih mudah dipisahkan dari zat lain dalam proses industri.
Titik didih etena bergantung pada tekanan dan kemurnian sampel. Pada tekanan yang lebih tinggi, titik didih etena meningkat. Demikian pula, pengotor yang ada dalam sampel dapat menyebabkan titik didih berbeda dari nilai yang diharapkan.
Titik Leleh Etena
Titik leleh etilen adalah -169,2°C (-272,6°F). Etilen merupakan molekul nonpolar dengan bentuk linier, menjadikannya molekul yang relatif sederhana dibandingkan banyak senyawa organik lainnya. Hal ini tercermin dari titik lelehnya yang rendah.
Sama seperti titik didih, titik leleh etilen dapat bervariasi tergantung kemurnian sampel. Pengotor dapat menurunkan titik leleh dan mempersulit perolehan sampel murni untuk tujuan eksperimen.
Kepadatan etilen g/ml
Kepadatan etilen adalah 0,958 g/mL pada kondisi suhu dan tekanan standar (STP), yang didefinisikan sebagai 0°C (32°F) dan tekanan 1 atm. Etilena kurang padat dibandingkan udara, sehingga dapat naik dan menyebar di atmosfer.
Kepadatan merupakan sifat fisik penting dari etilen karena digunakan dalam proses industri untuk menentukan jumlah etilen yang dibutuhkan untuk volume ruangan tertentu. Ini juga digunakan untuk menghitung massa etilen dalam sampel.
Berat molekul etilen
Berat molekul etilen adalah 28,05 g/mol. Ini adalah jumlah berat atom dari atom-atom yang menyusun molekul. Berat molekul merupakan parameter penting dalam banyak perhitungan kimia, khususnya dalam menentukan stoikiometri suatu reaksi dan jumlah reaktan serta produk yang diperlukan atau dihasilkan.
| Penampilan | Gas tidak berwarna |
| Kepadatan spesifik | 0,968 g/mL pada 20°C (68°F) |
| Warna | Tanpa warna |
| Bau | Manis, pedas |
| Masa molar | 28,05 g/mol |
| Kepadatan | 0,958 g/mL pada 0°C dan 1 atm |
| Titik fusi | -169,2°C (-272,6°F) |
| Titik didih | -103,7°C (-154,7°F) pada tekanan 1 atm |
| Titik kilat | -136°C (-213°F) |
| Kelarutan dalam air | 3,5 g/L pada 25°C (77°F) |
| Kelarutan | Tidak larut dalam air, larut dalam pelarut organik |
| Tekanan uap | 114,6 kPa pada 20°C (68°F) |
| Kepadatan uap | 0,97 (udara = 1) |
| pKa | 44 |
| pH | Tidak dapat diterapkan, karena etilen bukanlah larutan berair |
Keamanan dan Bahaya Etilen
Etilena adalah gas yang sangat mudah terbakar dan dapat membentuk campuran yang mudah meledak dengan udara. Ia dapat menyala secara spontan di udara jika konsentrasinya cukup tinggi. Ethylene juga menyebabkan sesak napas dan dapat menggantikan oksigen di ruang terbatas, sehingga menimbulkan bahaya yang mengejutkan.
Kontak dengan etilen cair atau paparan gas konsentrasi tinggi dapat menyebabkan radang dingin atau luka bakar. Etilen tidak beracun, namun produk pembakarannya, termasuk karbon monoksida dan karbon dioksida, dapat berbahaya bagi kesehatan manusia.
Penanganan etilen memerlukan tindakan keselamatan yang tepat, termasuk ventilasi yang memadai, peralatan pelindung diri, dan tindakan pencegahan keselamatan kebakaran. Etilen harus disimpan dan diangkut di tempat yang berventilasi baik, jauh dari sumber api.
| Simbol bahaya | Gas mudah terbakar (GHS02), sesak napas sederhana (GHS09) |
| Deskripsi Keamanan | Jauhkan dari sumber api – Dilarang merokok. Gunakan hanya alat yang tidak menimbulkan percikan api. Jangan menghirup gas. Gunakan hanya di luar ruangan atau di area yang berventilasi baik. Kenakan sarung tangan pelindung/pakaian pelindung/pelindung mata/pelindung wajah. |
| Nomor identifikasi PBB | PBB 1962 (gas terkompresi) |
| kode HS | 2901.21.00 |
| Kelas bahaya | 2.1 (gas yang mudah terbakar) |
| Kelompok pengepakan | T/A |
| Toksisitas | Tidak beracun |
Metode sintesis etilen
Berbagai metode dapat digunakan untuk mensintesis etilen, termasuk perengkahan termal hidrokarbon dan dehidrasi alkohol.
Dalam perengkahan termal, prosesnya melibatkan pemanasan hidrokarbon seperti metana, propana, dan nafta pada suhu tinggi (500 hingga 900 °C) dengan adanya katalis untuk memecah molekul rantai panjang menjadi molekul yang lebih kecil, sehingga menghasilkan etilen. produk.
Metode umum lainnya adalah dehidrasi alkohol, yang melibatkan penggunaan katalis seperti alumina atau silika pada suhu tinggi (250-350°C) untuk mendehidrasi etanol atau alkohol lainnya dan membentuk etilen dan air.
Perengkahan uap adalah proses lain yang digunakan untuk menghasilkan etilen, di mana uap ditambahkan ke hidrokarbon pada suhu tinggi (700-900°C) untuk menghasilkan campuran etilen dan produk lainnya.
Dekomposisi termal bahan organik seperti kayu, kertas dan plastik juga dapat menghasilkan etilen.
Metode lain untuk mensintesis etilen meliputi dehidrogenasi oksidatif etana dan proses pengubahan metanol menjadi olefin.
Kegunaan etilen
Ethylene adalah bahan kimia industri penting dengan berbagai kegunaan.
- Etilena memainkan peran penting dalam produksi polietilen, salah satu plastik yang paling banyak digunakan di dunia. Masyarakat menggunakan polietilen dalam berbagai aplikasi seperti pengemasan, pipa, dan bahan bangunan.
- Produsen menggunakan etilen sebagai bahan utama dalam produksi polimer lain, seperti polivinil klorida (PVC). PVC berguna dalam bahan bangunan, peralatan medis dan kabel listrik.
- Etilena juga penting dalam pembuatan etilen oksida, bahan baku penting dalam pembuatan deterjen, pelarut, dan plastik.
- Produsen menggunakan etilen untuk memproduksi etilen glikol, cairan pendingin dan antibeku untuk mesin. Ini juga merupakan bahan baku pembuatan serat poliester, film dan resin.
- Ethylene digunakan sebagai bahan bakar untuk pengelasan dan pemotongan logam. Ia juga bertindak sebagai agen pematangan buah-buahan dan sayuran.
- Etilena berguna dalam sintesis berbagai senyawa organik, termasuk etanol dan asetaldehida.
Secara keseluruhan, keserbagunaan etilen menjadikannya komponen penting dalam berbagai proses industri, dan berkontribusi terhadap banyak aspek kehidupan modern.
Pertanyaan:
Diena manakah yang akan bereaksi dengan etilen dalam reaksi Diels-Alder?
Setiap diena yang mengandung dua ikatan rangkap terkonjugasi dapat mengalami reaksi Diels-Alder dengan etena. Contoh diena tersebut termasuk 1,3-butadiena dan isoprena.
Bagaimana susunan atom hidrogen pada etena?
Dalam etena, dua atom karbon dihubungkan satu sama lain melalui ikatan rangkap. Setiap atom karbon juga terikat pada dua atom hidrogen, dengan sisa valensi ditempati oleh dua pasang elektron yang tidak digunakan bersama pada setiap atom karbon. Susunan atom di sekitar setiap karbon adalah trigonal.
Berapa banyak ikatan pi yang terbentuk ketika hibridisasi sp2 terjadi pada etena, C2H4?
Ketika hibridisasi sp2 terjadi pada etena, ikatan pi terbentuk antara dua atom karbon. Orbital hibrid sp2 berpartisipasi dalam pembentukan ikatan sigma antara atom karbon dan atom hidrogen, sedangkan orbital p setiap atom karbon tumpang tindih untuk membentuk ikatan pi. Etilen tergolong hidrokarbon tak jenuh karena memiliki ikatan rangkap antara dua atom karbonnya. Ikatan rangkap ini terdiri dari satu ikatan sigma dan satu ikatan pi, artinya etena memiliki atom hidrogen lebih sedikit dibandingkan hidrokarbon jenuh serupa dengan jumlah atom karbon yang sama.
