Emas klorida (AuCl3) adalah senyawa yang dibentuk dengan menggabungkan emas dengan klorin. Ini digunakan dalam berbagai aplikasi termasuk pelapisan emas dan sebagai katalis dalam reaksi kimia.
| Nama IUPAC | Emas(III) klorida |
| Formula molekul | AuCl3 |
| nomor CAS | 13453-07-1 |
| Sinonim | Aurat klorida, Trichlorogold, Emas triklorida |
| Di ChI | InChI=1S/3ClH.Au/h3*1H;/q;;;+3/p-3 |
Sifat emas klorida
Formula Emas Klorida
Rumus triklorida emas adalah AuCl3. Ini adalah senyawa kimia yang terdiri dari satu atom emas (Au) dan tiga atom klor (Cl). Rumus ini mewakili stoikiometri unsur-unsur yang ada dalam triklorida emas.
Massa Molar Emas Klorida
Massa molar triklorida emas dihitung dengan menjumlahkan massa atom unsur penyusunnya. Untuk emas triklorida (AuCl3), massa molarnya kira-kira 303,33 g/mol. Hal ini berguna untuk menentukan jumlah zat dalam sampel tertentu.
Titik didih emas klorida
Emas triklorida memiliki titik didih sekitar 254°C (derajat Celcius). Pada suhu ini, senyawa berubah wujud dari cair menjadi gas. Titik didih menunjukkan suhu di mana tekanan uap cairan sama dengan tekanan atmosfer.
Titik lebur emas klorida
Titik leleh emas triklorida kira-kira 254°C (derajat Celcius). Ini adalah suhu di mana bentuk padat suatu senyawa berubah menjadi cair. Memahami titik leleh sangat penting dalam berbagai proses industri.
Massa jenis emas klorida g/mL
Massa jenis emas triklorida kira-kira 4,7 g/mL (gram per mililiter). Massa jenis adalah ukuran massa per satuan volume suatu zat. Kepadatan triklorida emas yang relatif tinggi membuatnya lebih berat daripada air.
Emas klorida Berat molekul
Berat molekul triklorida emas, juga dikenal sebagai massa molar, adalah sekitar 303,33 g/mol (gram per mol). Ini adalah jumlah berat atom seluruh atom dalam senyawa. Berat molekul sangat penting dalam perhitungan kimia.
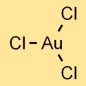
Struktur emas klorida
Emas triklorida (AuCl3) memiliki struktur molekul yang terdiri dari satu atom emas yang terikat pada tiga atom klor. Susunannya membentuk bentuk trigonal planar, dengan atom emas di tengah dan atom klor mengelilinginya.
Kelarutan emas klorida
Emas triklorida memiliki kelarutan terbatas dalam air. Ini larut lebih baik dalam pelarut organik tertentu, seperti etanol dan kloroform. Kelarutan emas triklorida dipengaruhi oleh faktor-faktor seperti suhu dan sifat pelarut.
| Penampilan | Kuning padat |
| Berat jenis | ~4,7 gram/mL |
| Warna | KUNING |
| Bau | Tidak berbau |
| Masa molar | ~303,33 g/mol |
| Kepadatan | ~4,7 gram/mL |
| Titik fusi | ~254°C |
| Titik didih | ~254°C |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Kelarutan terbatas |
| Kelarutan | Larut dalam beberapa pelarut organik seperti etanol dan kloroform |
| Tekanan uap | Tidak tersedia |
| Kepadatan uap | Tidak tersedia |
| pKa | Tidak tersedia |
| pH | Netral (pH 7) |
Keamanan dan bahaya emas klorida
Emas triklorida berpotensi menimbulkan bahaya keselamatan dan memerlukan penanganan yang hati-hati. Penting untuk mengenakan peralatan pelindung yang sesuai, seperti sarung tangan dan kacamata pengaman, untuk menghindari kontak kulit dan iritasi mata. Menghirup debu atau uapnya harus dihindari karena potensi masalah pernapasan. Selain itu, paparan suhu tinggi dapat mengakibatkan pelepasan gas klorin beracun. Senyawa ini juga tidak kompatibel dengan zat pereduksi kuat, sehingga dapat menyebabkan reaksi berbahaya. Tindakan penyimpanan, pelabelan, dan penahanan yang tepat diperlukan untuk mencegah kecelakaan. Memahami bahaya dan tindakan pencegahan keselamatan ini sangat penting ketika bekerja dengan emas triklorida di laboratorium atau lingkungan industri.
| Simbol bahaya | Bahaya |
| Deskripsi Keamanan | Tangani dengan hati-hati. Hindari kontak dengan kulit dan mata. Jangan menghirup debu atau uap. Jauhkan dari zat pereduksi kuat. |
| Nomor identifikasi PBB | Tidak tersedia |
| kode HS | 2843.29 |
| Kelas bahaya | 6.1 (Zat beracun) |
| Kelompok pengepakan | II |
| Toksisitas | Sangat beracun jika tertelan atau terhirup. Dapat menyebabkan iritasi kulit dan mata. |
Metode sintesis emas klorida
Beberapa metode memungkinkan sintesis emas triklorida.
Pendekatan yang umum adalah dengan melarutkan emas atau emas oksida dalam asam klorida (HCl) . Reaksi tersebut menghasilkan emas triklorida dan air. Metode lain melibatkan mereaksikan emas dengan gas klor, secara langsung membentuk emas triklorida. Alternatifnya, gas klor dapat bereaksi dengan emas metalik dengan adanya katalis seperti besi klorida, menghasilkan emas triklorida dan besi klorida sebagai produk sampingan.
Rute sintesis lainnya melibatkan mereaksikan emas metalik dengan aqua regia, campuran asam nitrat pekat (HNO3) dan asam klorida . Sifat pengoksidasi yang kuat dari Aqua regia mengubah emas menjadi emas triklorida, yang dapat diisolasi melalui penguapan. Emas triklorida terbentuk ketika asam klorida bereaksi dengan emas(III) oksida (Au2O3), menghasilkan emas triklorida dan air.
Berbagai zat pereduksi, seperti timah(II) klorida (SnCl2) atau sulfur dioksida (SO2), dapat secara aktif mereduksi emas(V) klorida (AuCl5) untuk mensintesis emas triklorida. Reaksi tersebut menghasilkan emas triklorida dan klorida dari zat pereduksi yang sesuai.
Setiap metode memiliki kelebihan dan penerapannya masing-masing, bergantung pada bahan mentah yang tersedia dan kemurnian triklorida emas yang diinginkan. Pertimbangan yang cermat terhadap kondisi reaksi dan langkah-langkah keamanan sangat penting selama proses sintesis.
Kegunaan emas klorida
Emas triklorida menemukan berbagai aplikasi karena sifat uniknya:
- Pelapisan Emas: Emas triklorida berfungsi sebagai sumber ion emas untuk proses pelapisan listrik, memungkinkan lapisan tipis emas diendapkan pada permukaan. Hal ini meningkatkan konduktivitas dan memberikan hasil akhir yang menarik dan tahan korosi.
- Katalis: Emas triklorida bertindak sebagai katalis dalam berbagai reaksi kimia, khususnya dalam sintesis organik. Kemampuannya untuk mengaktifkan koneksi tertentu membuatnya berharga untuk mendorong reaksi tertentu.
- Kedokteran: Para peneliti telah mengeksplorasi senyawa triklorida emas untuk aplikasi terapeutik potensial dalam pengobatan arthritis dan penyakit inflamasi lainnya.
- Fotografi: Dalam fotografi, emas triklorida digunakan sebagai toner, memberikan warna ungu dan coklat pada cetakan hitam putih.
- Kaca dan keramik: Industri kaca menggunakan emas triklorida untuk menghasilkan kaca rubi, memberikan warna merah, dan keramik mendapat manfaat dari penggunaannya untuk meningkatkan warna.
- Nanoteknologi: Emas triklorida memainkan peran penting dalam nanoteknologi dengan memfasilitasi sintesis nanopartikel emas, yang memiliki aplikasi dalam elektronik, katalisis, dan pencitraan medis.
- Agen antibakteri: Nanopartikel emas triklorida telah terbukti menjanjikan sebagai agen antibakteri, secara efektif menghambat pertumbuhan bakteri tertentu.
- Konservasi Seni: Dalam restorasi seni, para ahli menggunakan emas triklorida untuk menyepuh dan menciptakan kembali pigmen bersejarah.
- Reagen Laboratorium: Para ilmuwan menggunakannya sebagai reagen laboratorium untuk berbagai analisis kimia dan tujuan penelitian.
- Tinta Metalik: Produsen menggunakan tinta triklorida emas untuk keperluan pencetakan, memberikan sentuhan kemewahan pada produk seperti alat tulis dan kemasan.
Karena keserbagunaan dan sifat uniknya, emas triklorida tetap relevan di berbagai industri, memainkan peran penting dalam teknologi, seni, kedokteran, dan ilmu material.
Pertanyaan:
T: Bahan kimia apa yang dapat saya gunakan untuk mengendapkan emas dari emas klorida?
A: Natrium metabisulfit (Na2S2O5) dapat digunakan sebagai zat pereduksi untuk mengendapkan emas dari larutan emas triklorida.
Q: Apakah emas monoatomik terkandung dalam emas klorida?
J: Tidak, emas monoatomik bukanlah emas triklorida; itu adalah bentuk emas berbeda yang terdiri dari atom-atom individual, bukan dalam keadaan majemuk.
Q: Berapa massa molar emas III klorida?
A: Massa molar emas triklorida III (AuCl3) kira-kira 303,33 g/mol.
T: Apa itu emas klorida?
A: Emas triklorida (AuCl3) adalah senyawa kimia yang dibentuk dengan menggabungkan emas dengan klorin, digunakan dalam berbagai aplikasi seperti pelapisan emas dan katalisis.
T: Bagaimana cara membuat stannous klorida untuk menguji emas?
A: Stannous klorida (SnCl2) dapat dibuat dengan melarutkan timah logam dalam asam klorida (HCl), diikuti dengan reduksi.
Q: Berapa massa molar AuCl3?
A: Massa molar AuCl3 (emas III triklorida) kira-kira 303,33 g/mol.
Q: Berapa persentase emas dalam AuCl3?
A: Persentase emas dalam AuCl3 sekitar 42,49%.
Q: Berapa mol H2O dalam 3,4 g AuCl3 · 2 H2O?
A: Terdapat 0,0349 mol H2O dalam 3,4 g AuCl3 · 2 H2O.
Q: Apakah AuCl3 larut dalam air?
A: Ya, AuCl3 (emas III triklorida) larut dalam air sampai batas tertentu.
T: Berapa gram emas yang dapat diperoleh dari 35g AuCl3?
J: Sekitar 14,87 gram emas dapat diperoleh dari 35 g AuCl3.
Q: Berapakah kelarutan molar AuCl3? Ksp = 3,2 × 10−25
A: Kelarutan molar AuCl3, jika diketahui Ksp = 3,2 × 10−25, kira-kira 1,8 × 10^-9 mol/L.
