Diethylamine (DEA) merupakan senyawa kimia yang memiliki bau menyengat mirip amonia. Ini digunakan dalam produksi pestisida, obat-obatan dan akselerator karet. Hal ini dapat menyebabkan iritasi pada kulit, mata, dan sistem pernapasan.
| Nama IUPAC | N,N-dietilmetanamina |
| Formula molekul | C4H11N |
| nomor CAS | 109-89-7 |
| Sinonim | N-etil-etanamina, DEA, dietilamina, N,N-dietilamina, N-etiletanamina, dietilamina |
Sifat dietilamina
Formula Dietilamina
Rumus dietilamina adalah C4H11N. Ini adalah amina alifatik primer dengan dua gugus etil yang terikat pada atom nitrogen. Struktur molekul dietilamina mengandung atom nitrogen pusat yang terikat pada dua gugus etil dan satu atom hidrogen.
Massa Molar Dietilamina
Massa molar DEA adalah 73,14 g/mol. Ini dihitung dengan menambahkan massa atom dari semua atom yang ada dalam molekul DEA. Massa molar merupakan parameter penting yang digunakan untuk menghitung jumlah DEA yang dibutuhkan untuk reaksi kimia tertentu.
Titik didih dietilamina
Titik didih DEA adalah 55,8°C. Artinya pada suhu tersebut DEA yang berbentuk cair akan mulai menguap dan berubah menjadi gas. Titik didih merupakan parameter penting yang menentukan kondisi yang diperlukan agar suatu reaksi kimia dapat berlangsung.
Titik Leleh Dietilamina
Titik leleh DEA adalah -49,8°C. Artinya pada suhu tersebut, DEA yang berbentuk padat akan mulai meleleh dan berubah menjadi cair. Titik leleh merupakan parameter penting yang digunakan untuk menentukan kemurnian DEA.
Kepadatan Dietilamina g/mL
Massa jenis DEA adalah 0,707 g/mL. Artinya satu mililiter DEA beratnya 0,707 gram. Kepadatan merupakan parameter penting yang digunakan untuk menghitung jumlah DEA yang dibutuhkan untuk reaksi kimia tertentu.
Berat Molekul Dietilamina
Berat molekul DEA adalah 73,14 g/mol. Ini adalah jumlah berat atom semua atom dalam molekul DEA. Berat molekul merupakan parameter penting yang digunakan untuk menghitung jumlah DEA yang dibutuhkan untuk reaksi kimia tertentu.
Struktur dietilamina
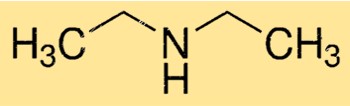
DEA memiliki struktur molekul linier, dengan atom nitrogen pusat terikat pada dua gugus etil dan satu atom hidrogen. Molekul tersebut memiliki bentuk piramida trigonal karena adanya pasangan elektron bebas pada atom nitrogen. Struktur ini penting dalam menentukan reaktivitas dan sifat DEA.
Kelarutan dietilamina
DEA larut dalam air dan banyak pelarut organik. PKa-nya 10,75 yang berarti basa lemah. Kelarutan DEA bergantung pada faktor-faktor seperti suhu, pH dan polaritas pelarut. Kelarutannya dalam air adalah 100 g/L pada 25°C.
| Penampilan | Cairan tidak berwarna |
| Berat jenis | 0,707 gram/ml |
| Warna | Tanpa warna |
| Bau | Mirip dengan amonia |
| Masa molar | 73,14 g/mol |
| Kepadatan | 0,707 gram/ml |
| Titik fusi | -49,8°C |
| Titik didih | 55,8°C |
| Titik kilat | -15°C |
| Kelarutan dalam air | Larut |
| Kelarutan | Larut dalam banyak pelarut organik |
| Tekanan uap | 94,7 mmHg pada 25°C |
| Kepadatan uap | 2.5 |
| pKa | 10:75 |
| pH | Dasar |
Keamanan dan bahaya dietilamina
DEA dapat berbahaya bagi kesehatan manusia jika tidak ditangani dengan baik. Ini bersifat korosif dan dapat menyebabkan iritasi pada kulit, mata dan saluran pernapasan jika bersentuhan. Paparan DEA dalam waktu lama dapat menyebabkan kerusakan hati dan ginjal. Bahan ini mudah terbakar dan dapat membentuk campuran yang mudah meledak dengan udara. Tindakan pencegahan khusus seperti ventilasi yang memadai, peralatan pelindung diri dan wadah penyimpanan tahan api harus dilakukan saat menangani AED. Jika terjadi paparan yang tidak disengaja, perhatian medis segera harus dicari. Penting untuk mengikuti semua pedoman dan protokol keselamatan saat bekerja dengan DEA untuk menjaga keselamatan diri sendiri dan orang lain.
| Simbol bahaya | Korosif, Mudah Terbakar |
| Deskripsi Keamanan | Jauhkan dari panas, percikan api, nyala api terbuka, dan permukaan yang panas. Hindari menghirup uap, kabut, atau gas. Kenakan sarung tangan pelindung, pelindung mata, dan pelindung wajah. Gunakan di area yang berventilasi baik. |
| Nomor identifikasi PBB | PBB 1154 |
| kode HS | 29211990 |
| Kelas bahaya | 3 |
| Kelompok pengepakan | II |
| Toksisitas | Dapat menyebabkan iritasi pada kulit, mata dan saluran pernafasan. Paparan yang terlalu lama dapat menyebabkan kerusakan hati dan ginjal. |
Metode sintesis dietilamina
Ada beberapa metode untuk mensintesis DEA, antara lain reaksi etanol dan amonia atau reaksi dietil sulfat dan amonia.
Salah satu metodenya melibatkan pemanasan campuran etanol dan amonia dengan adanya katalis, seperti alumina atau silika gel. Reaksi tersebut menghasilkan DEA dan air, yang dapat dipisahkan dengan distilasi.
Metode lain melibatkan reaksi dietil sulfat dengan amonia . Reaksi berlangsung dalam pelarut, seperti metanol atau etanol, dan menghasilkan DEA sulfat. Untuk menghasilkan DEA dan natrium sulfat, DEA sulfat dapat diolah dengan basa kuat, seperti natrium hidroksida.
Untuk mensintesis DEA, etilen dapat direaksikan dengan amonia dengan adanya katalis, seperti oksida besi. Reaksi tersebut menghasilkan campuran DEA dan trietilamina, yang dapat dipisahkan dengan distilasi.
Saat mensintesis DEA, kehati-hatian harus dilakukan karena reagen dan produk dapat menimbulkan risiko terhadap kesehatan manusia dan lingkungan. Oleh karena itu, perlu menggunakan tindakan dan peralatan keselamatan yang tepat selama proses sintesis.
Kegunaan dietilamina
DEA memiliki beberapa kegunaan di berbagai industri karena sifatnya yang unik. Berikut adalah beberapa kegunaan umum:
- Farmasi: Digunakan sebagai bahan penyusun dalam sintesis obat-obatan, seperti anestesi lokal dan antihistamin.
- Bahan kimia pertanian: digunakan sebagai bahan mentah dalam produksi herbisida, seperti glifosat.
- Industri karet: Digunakan dalam produksi akselerator untuk vulkanisasi karet.
- Industri pewarna: digunakan dalam produksi pewarna dan pigmen, seperti pewarna asam dan pewarna reaktif.
- Inhibitor Korosi: Digunakan sebagai inhibitor korosi dalam industri perminyakan untuk melindungi jaringan pipa dan tangki penyimpanan dari korosi.
- Pelarut: Digunakan sebagai pelarut dalam produksi resin dan polimer sintetis.
- Sintesis kimia: Juga digunakan sebagai reagen dalam berbagai reaksi sintesis kimia.
Pertanyaan:
T: Mana yang lebih basa, trietilamina atau dietilamina?
J: Trietilamina lebih basa daripada DEA karena ukurannya yang lebih besar dan adanya tiga gugus etil yang membantu meningkatkan kerapatan elektron.
Q: Berapakah pH dari dietilamina 0,10 M, (CH3CH2)2NH, (Kb = 8,6 × 10−4)?
A: PH larutan DEA 0,10 M dapat dihitung menggunakan nilai Kb dan persamaan konstanta disosiasi basa. PH larutan kira-kira 10,49.
Q: Berapa pH dietilamina 0,11 M, (CH3CH2)2NH, (Kb = 8,6 × 10−4)?
A: PH larutan DEA 0,11 M dapat dihitung menggunakan nilai Kb dan persamaan konstanta disosiasi basa. PH larutan kira-kira 10,50.
Q: Berapa entalpi pembentukan standar dietilamina cair, (CH3CH2)2NH?
A: Entalpi standar pembentukan DEA cair adalah -42,52 kJ/mol.
T: Apakah dietilamina bersifat polar?
J: Ya, DEA bersifat polar karena adanya atom nitrogen dengan sepasang elektron bebas dan perbedaan elektronegativitas antara nitrogen dan karbon.
T: Mana yang lebih basa, dietilamina atau trietilamina?
J: Trietilamina lebih basa daripada DEA karena adanya tiga gugus etil yang membantu meningkatkan kerapatan elektron.
Q: Berapa pH larutan dietilamina 0,10 M?
A: PH larutan DEA 0,10 M dapat dihitung menggunakan nilai Kb dan persamaan konstanta disosiasi basa. PH larutan kira-kira 10,49.
T: Apakah dietilamina termasuk asam kuat atau asam lemah?
A: DEA adalah basa lemah, bukan asam kuat. Bereaksi dengan air menghasilkan ion hidroksida dan ion dietilamonium.
