Klorin trifluorida atau ClF3 adalah senyawa kimia yang sangat reaktif dan beracun yang digunakan dalam propelan roket, bahan pembersih, dan sebagai zat pengoksidasi dalam reaksi kimia. Bahan ini dapat menyebabkan luka bakar parah dan terbakar secara spontan jika terkena bahan organik.
| Nama IUPAC | Klorin trifluorida |
| Formula molekul | ClF3 |
| nomor CAS | 7790-91-2 |
| Sinonim | Klorin fluorida, Trifluoroklore, Triklorofluorida, Fluoroklor, Kloril fluorida, Fluor klorida |
| Di ChI | InChI=1S/ClF3/c2-1(3)4 |
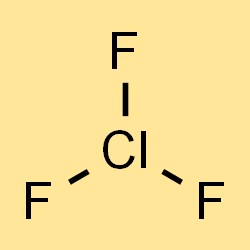
Rumus klorin trifluorida
Rumus kimia klorin trifluorida adalah ClF3, yang mewakili tiga atom fluor dan satu atom klor dalam molekul. Rumusnya dapat digunakan untuk menghitung massa molar, massa jenis, dan sifat fisik klorin trifluorida lainnya. Rumusnya juga menunjukkan jenis dan jumlah atom yang ada dalam senyawa, yang penting untuk memahami sifat kimia dan reaktivitasnya.
Massa molar Klorin Trifluorida
Massa molar klorin trifluorida (ClF3) adalah 92,45 g/mol. Nilai tersebut dihitung dengan menjumlahkan berat atom unsur-unsur penyusunnya, yaitu 35,45 g/mol untuk klorin dan 37,996 g/mol untuk fluor. Massa molar klorin trifluorida penting dalam perhitungan kimia dan dalam menentukan jumlah senyawa dalam sampel tertentu.
Titik didih klorin trifluorida
Klorin trifluorida memiliki titik didih 11,75°C pada tekanan standar. Hal ini menjadikannya senyawa yang mudah menguap dan sangat reaktif yang dapat dengan mudah menguap dan membentuk asap beracun. Titik didih yang rendah dari klor trifluorida disebabkan oleh lemahnya gaya antarmolekul di antara molekul-molekulnya, sehingga memungkinkan molekul-molekul tersebut terpecah dan keluar sebagai gas pada suhu yang relatif rendah.
Titik lebur klorin trifluorida
Klorin trifluorida memiliki titik leleh -76,3°C (-105,3°F) pada tekanan standar. Hal ini membuatnya menjadi padat pada suhu dan tekanan kamar, namun dapat dengan mudah menyublim dan membentuk asap beracun karena volatilitasnya yang tinggi. Rendahnya titik leleh klorin trifluorida disebabkan oleh lemahnya gaya antarmolekul antar molekulnya, yang memungkinkannya terpecah dan menjadi gas pada suhu yang relatif rendah.
Kepadatan klorin trifluorida g/ml
Massa jenis klorin trifluorida adalah 1,77 g/mL pada suhu dan tekanan standar (STP). Nilai ini lebih tinggi dibandingkan udara (1,29 g/mL), yang membuat klorin trifluorida menjadi gas yang lebih padat daripada udara. Kepadatan tinggi klorin trifluorida disebabkan oleh berat molekulnya yang lebih tinggi dibandingkan sebagian besar gas di atmosfer.
Berat molekul klorin trifluorida
Berat molekul klorin trifluorida adalah 92,45 g/mol. Nilai tersebut dihitung dengan menjumlahkan berat atom unsur-unsur penyusunnya, yaitu 35,45 g/mol untuk klorin dan 37,996 g/mol untuk fluor. Berat molekul klorin trifluorida yang tinggi menjadikannya gas padat, lebih berat daripada udara.
Struktur klorin trifluorida
Klorin trifluorida memiliki geometri molekul trigonal bipiramida, dengan atom klor pusat terikat pada tiga atom fluor pada posisi ekuator dan dua situs kosong pada posisi aksial. Struktur ini menghasilkan molekul polar, dengan dua posisi aksial bermuatan parsial positif dan tiga posisi ekuator bermuatan parsial negatif.
| Penampilan | Gas atau cairan tidak berwarna hingga kuning pucat |
| Berat jenis | 1.77 |
| Warna | Tidak berwarna sampai kuning pucat |
| Bau | Bau yang menyengat dan menyesakkan |
| Masa molar | 92,45 g/mol |
| Kepadatan | 1,77 g/mL pada STP |
| Titik fusi | -76,3°C (-105,3°F) |
| Titik didih | 11,75°C |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Bereaksi hebat dengan air |
| Kelarutan | Larut dalam asam sulfat, asam nitrat dan zat pengoksidasi lainnya |
| Tekanan uap | 1,73 ATM pada suhu 20°C |
| Kepadatan uap | 3.2 (udara = 1) |
| PKa | Tak dapat diterapkan |
| pH | Tak dapat diterapkan |
Keamanan dan bahaya klorin trifluorida
Klorin trifluorida adalah senyawa yang sangat reaktif dan berbahaya. Hal ini menimbulkan risiko kesehatan dan keselamatan yang serius dan harus ditangani dengan sangat hati-hati. Dapat menyebabkan luka bakar serius, korosi dan iritasi jika terkena kulit, mata, dan selaput lendir. Menghirup uapnya dapat menyebabkan gangguan pernafasan, batuk dan nyeri dada. Klorin trifluorida juga dapat menyala dan bereaksi hebat dengan bahan organik, logam, dan air, sehingga menyebabkan ledakan dan kebakaran. Peralatan pelindung khusus, seperti pakaian tahan bahan kimia dan respirator, harus dipakai saat menangani klorin trifluorida, dan hanya boleh digunakan di lingkungan berventilasi baik dan dikendalikan oleh profesional terlatih.
| Simbol bahaya | Korosif, Pengoksidasi |
| Deskripsi Keamanan | Jauhkan dari panas, percikan api, nyala api terbuka, permukaan panas dan sumber api. Kenakan pakaian dan peralatan pelindung. Hindari kontak dengan kulit, mata dan pakaian. Jangan menghirup asap atau uap. Jangan menelan. Gunakan hanya di area yang berventilasi baik. |
| Sebuah pengidentifikasi | tahun 1749 |
| kode HS | 281211 |
| Kelas bahaya | 8 |
| Kelompok pengepakan | SAYA |
| Toksisitas | Sangat beracun |
Metode sintesis klorin trifluorida
Fluorinasi langsung gas klor dapat mensintesis klor trifluorida. Hidrogen fluorida dan gas klor dapat bereaksi untuk mensintesis klor trifluorida.
Campuran gas klor dan gas fluor bereaksi pada lapisan karbon aktif atau bahan inert lainnya pada suhu tinggi untuk menghasilkan klor trifluorida dalam metode fluorinasi langsung.
Metode lain melibatkan reaksi antara hidrogen fluorida dan gas klor. Dalam metode ini, kedua gas melewati katalis, seperti alumina aktif atau platina, pada suhu tinggi. Reaksi antara kedua gas tersebut menghasilkan klorin trifluorida dan hidrogen klorida sebagai produk sampingan.
Sulfur tetrafluorida dan gas klor bereaksi dengan adanya katalis, seperti besi atau nikel, pada suhu tinggi untuk mensintesis klor trifluorida dan menghasilkan sulfur dioksida sebagai produk sampingan.
Peralatan khusus dan penanganan yang hati-hati diperlukan untuk setiap metode ini karena sifat berbahaya dari klorin trifluorida. Keselamatan personel dan lingkungan harus dipastikan selama proses sintesis melalui tindakan keselamatan yang tepat seperti pakaian tahan bahan kimia dan sistem ventilasi.
Kegunaan klorin trifluorida
Klorin trifluorida (ClF3) memiliki beberapa aplikasi industri karena sifatnya yang sangat reaktif dan sifat pengoksidasi yang kuat.
- ClF3 membersihkan dan mengetsa bahan semikonduktor seperti silikon dan germanium dengan menghilangkan kontaminan dan kotoran yang tidak diinginkan dari permukaannya.
- ClF3 mengubah uranium oksida menjadi uranium heksafluorida untuk produksi bahan bakar nuklir. Uranium heksafluorida diperkaya untuk digunakan dalam reaktor nuklir.
- ClF3 meningkatkan efisiensi pembakaran dan menghasilkan daya dorong yang lebih besar bila digunakan dalam kombinasi dengan zat pengoksidasi lain seperti hidrazin atau hidrogen dalam propelan roket dan pengoksidasi berenergi tinggi untuk sistem bahan bakar.
- ClF3 memutihkan tekstil dan produk kertas.
- ClF3 menghasilkan bahan kimia tertentu seperti gas fluor dan fluorokarbon.
Karena sifatnya yang berbahaya, klorin trifluorida harus ditangani dengan sangat hati-hati dalam semua penerapannya, dan hanya oleh profesional terlatih dengan peralatan dan protokol keselamatan yang sesuai.
Pertanyaan:
T: Apakah klorin trifluorida bersifat polar atau non-polar?
A: Klorin trifluorida adalah molekul polar karena perbedaan elektronegativitas antara atom klor dan fluor.
T: Bagaimana cara memadamkan klorin trifluorida?
A: Klorin trifluorida dapat dipadamkan menggunakan pasir kering, grafit, atau natrium klorida. Air tidak boleh digunakan untuk memadamkan api klorin trifluorida, karena dapat bereaksi hebat dan melepaskan gas beracun.
Q: Struktur Lewis klorin trifluorida?
A: Struktur Lewis ClF3 terdiri dari atom klor pusat yang dikelilingi oleh tiga atom fluor. Atom klor terikat ke masing-masing dari tiga atom fluor melalui ikatan tunggal, dan terdapat satu pasang elektron pada atom klor.
Q: Berapa muatan formal atom klor dalam molekul klor trifluorida?
J: Muatan formal atom klor dalam klor trifluorida adalah nol. Atom klor memiliki tujuh elektron valensi dan terikat pada tiga atom fluor, yang memiliki elektronegativitas lebih tinggi daripada klor. Pasangan elektron bebas pada atom klor tidak terlibat dalam ikatan apa pun dan oleh karena itu tidak diperhitungkan saat menentukan muatan formal.
T: Kebakaran klorin trifluorida?
J: Klorin trifluorida adalah zat yang sangat reaktif dan mudah terbakar yang dapat terbakar secara spontan jika bersentuhan dengan bahan organik atau bahkan udara. Jika terjadi kebakaran akibat klorin trifluorida, pasir kering, grafit, atau natrium klorida harus digunakan untuk memadamkan api, dan air tidak boleh digunakan karena dapat menyebabkan reaksi hebat. Mengevakuasi area tersebut dan segera mencari pertolongan medis jika terpapar juga penting jika terjadi kebakaran klorin trifluorida.
