Kalsium sulfit (CaSO3) merupakan senyawa yang mengandung ion Ca2+ dan SO32-. Ini sering digunakan sebagai pengawet makanan, antioksidan dan pemurni air karena kemampuannya menghilangkan kotoran dan mencegah pembusukan.
| Nama IUPAC | Kalsium sulfit |
| Formula molekul | CaSO3 |
| nomor CAS | 10257-55-3 |
| Sinonim | Kalsium sulfit; Asam sulfat, garam kalsium; asam kalsium sulfat; asam kalsium sulfat; E226 |
| Di ChI | InChI=1S/Ca.H2O3S/c;1-4(2)3/jam;(H2,1,2,3)/q+2;/p-2 |
Sifat kalsium sulfit
Formula Kalsium Sulfit
Rumus kimia kalsium sulfit adalah CaSO3. Senyawa ini tersusun atas ion Ca2+ dan ion SO32-. Kalsium sulfit dapat dibuat dengan mereaksikan kalsium hidroksida dengan asam sulfat. Ini biasa digunakan dalam industri makanan sebagai pengawet dan antioksidan, serta pemurni air.
Massa Molar Kalsium Sulfit
Massa molar CaSO3 adalah 120,14 g/mol. Hal ini dapat dihitung dengan menambahkan massa atom kalsium (40,08 g/mol), belerang (32,06 g/mol), dan tiga atom oksigen (masing-masing 16,00 g/mol).
Titik didih kalsium sulfit
CaSO3 tidak mempunyai titik didih yang pasti karena ia terurai sebelum mencapai titik didihnya. Namun, dapat dipanaskan hingga suhu sekitar 450°C sebelum terjadi dekomposisi. Hal ini dikarenakan CaSO3 merupakan senyawa yang tidak stabil dan cenderung terurai menjadi kalsium sulfat dan sulfur dioksida jika dipanaskan.
Titik Leleh Kalsium Sulfit
Titik leleh CaSO3 kira-kira 1520°C. Ini adalah suhu di mana senyawa padat berubah menjadi cair. CaSO3 memiliki struktur kristal dan meleleh pada suhu tinggi karena ikatan ion yang kuat antara ion kalsium dan sulfit.
Massa jenis kalsium sulfit g/mL
Kepadatan CaSO3 sekitar 2,71 g/mL. Artinya satu mililiter CaSO3 mempunyai massa 2,71 gram. Tingginya kepadatan CaSO3 disebabkan oleh adanya ion kalsium yang memiliki massa atom tinggi.
Berat Molekul Kalsium Sulfit
Berat molekul CaSO3 adalah 120,14 g/mol. Hal ini dapat dihitung dengan menambahkan berat atom kalsium, belerang dan tiga atom oksigen dalam senyawa. Berat molekul CaSO3 penting dalam menentukan sifat fisik dan kimianya.
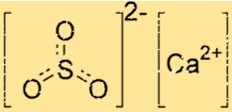
Struktur kalsium sulfit
Struktur CaSO3 terdiri dari satu ion Ca2+ dan satu ion SO32-. Ion kalsium dikelilingi oleh enam atom oksigen, sedangkan ion sulfit memiliki dua atom oksigen dan satu atom belerang. Ion Ca2+ dan ion SO32- disatukan oleh ikatan ionik, yang merupakan gaya tarik menarik elektrostatis yang kuat antara ion-ion yang bermuatan berlawanan.
Kelarutan kalsium sulfit
CaSO3 sulit larut dalam air, dengan kelarutan sekitar 0,17 g/100 mL pada suhu kamar. Artinya hanya sejumlah kecil CaSO3 yang dapat larut dalam air dan sisa partikel padatnya akan tetap tersuspensi di dalam air. Kelarutan CaSO3 dipengaruhi oleh faktor-faktor seperti suhu, pH dan keberadaan ion lain.
| Penampilan | Bubuk putih atau padatan kristal |
| Berat jenis | 2.71 |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 120,14 g/mol |
| Kepadatan | 2,71 gram/ml |
| Titik fusi | 1520°C |
| Titik didih | Terurai sebelum mencapai titik didih |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sedikit larut, kira-kira. 0,17 g/100 mL pada suhu kamar. |
| Kelarutan | Tidak larut dalam alkohol dan eter |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | 1.91 |
| pH | Sedikit basa (pH 8-9 bila dilarutkan dalam air) |
Keamanan dan Bahaya Kalsium Sulfit
CaSO3 umumnya dianggap aman untuk digunakan dalam aplikasi pengolahan makanan dan air. Namun, seperti bahan kimia lainnya, bahan ini dapat menimbulkan bahaya tertentu jika tidak ditangani dengan benar. CaSO3 mengiritasi kulit dan mata dan dapat menyebabkan iritasi pernafasan jika terhirup. Menelan CaSO3 dalam jumlah besar dapat menyebabkan mual, muntah, dan diare. Saat menangani CaSO3, tindakan pencegahan keselamatan yang tepat harus dilakukan, seperti memakai sarung tangan dan kacamata pelindung. Seseorang harus segera mencari pertolongan medis jika terkena CaSO3 pada kulit, mata, atau jika tertelan. Penting juga untuk mengikuti prosedur penyimpanan dan pembuangan CaSO3 yang benar untuk meminimalkan potensi bahaya.
| Simbol bahaya | Tidak ada yang ditugaskan |
| Deskripsi Keamanan | Hindari kontak dengan mata, kulit dan pakaian. Kenakan sarung tangan dan kacamata pelindung saat menangani. Jika terjadi kontak, bilas area yang terkena dengan air. Jika tertelan, segera dapatkan bantuan medis. |
| Nomor identifikasi PBB | Tak dapat diterapkan |
| kode HS | 283210 |
| Kelas bahaya | Tidak tergolong berbahaya |
| Kelompok pengepakan | Tak dapat diterapkan |
| Toksisitas | Kalsium sulfit dianggap tidak beracun pada konsentrasi rendah, namun dapat menyebabkan iritasi gastrointestinal dan efek kesehatan lainnya pada dosis tinggi. |
Metode sintesis kalsium sulfit
Reaksi asam sulfat dengan kalsium hidroksida dapat mensintesis CaSO3. Reaksi tersebut menghasilkan CaSO3 dan air sebagai produk sampingan.
Metode lain melibatkan mereaksikan kalsium karbonat dengan asam sulfat, yang menghasilkan CaSO3, air dan karbon dioksida. Biasanya, ahli kimia melakukan reaksi dalam larutan berair pada suhu kamar atau sedikit lebih tinggi.
Dalam metode lain, mereaksikan kalsium oksida dengan sulfur dioksida dan kemudian menambahkan air ke produk yang dihasilkan menghasilkan CaSO3.
Dalam lingkungan industri, penyerapan sulfur dioksida dalam suspensi kalsium hidroksida umumnya menghasilkan CaSO3. Proses ini menghasilkan campuran CaSO3 dan kalsium sulfat, yang dapat dipisahkan dengan filtrasi atau metode lain. CaSO3 yang dihasilkan dapat digunakan dalam berbagai aplikasi, termasuk pengolahan air dan sebagai pengawet makanan.
Secara keseluruhan, ada beberapa metode untuk mensintesis CaSO3, masing-masing memiliki kelebihan dan keterbatasan tergantung pada aplikasi spesifik dan kemurnian produk akhir yang diinginkan.
Kegunaan Kalsium Sulfit
CaSO3 memiliki berbagai kegunaan di berbagai industri karena sifatnya yang unik. Beberapa kegunaan umum CaSO3 meliputi:
- Pengolahan Air: Sering digunakan sebagai bahan pengolahan air untuk menghilangkan kotoran dan mendisinfeksi air. Secara efektif dapat menghilangkan klorin, logam berat dan kontaminan lainnya dari air.
- Pengawetan Makanan: Digunakan sebagai pengawet makanan untuk mencegah pembusukan dan memperpanjang umur simpan produk makanan. Umumnya digunakan dalam produksi makanan kaleng dan botolan, serta dalam pembuatan anggur dan bir.
- Industri kimia: Digunakan dalam industri kimia sebagai zat pereduksi dan produksi asam sulfat.
- Konstruksi: Digunakan sebagai komponen bahan bangunan seperti drywall dan semen.
- Industri pertanian: Digunakan dalam pertanian untuk mengolah tanah dan mencegah penyakit tanaman.
- Aplikasi Medis: Juga digunakan dalam aplikasi medis sebagai antioksidan dan sebagai pengobatan untuk kondisi medis tertentu.
Pertanyaan:
Q: Apa rumus kalsium sulfit?
A: Rumus kalsium sulfit adalah CaSO3.
T: Bagaimana kondisi kalsium sulfit?
A: CaSO3 berbentuk padat pada suhu kamar.
Q: Berapa gram kalsium dalam 3,36 gram CaSO3?
A: Terdapat sekitar 1,14 gram kalsium dalam 3,36 gram CaSO3.
T: Apa yang terjadi jika Anda menambahkan kalsium karbonat ke asam klorida dan natrium sulfit?
A: Ketika kalsium karbonat ditambahkan ke asam klorida dan natrium sulfit, terjadi reaksi yang menghasilkan CaSO3, air, karbon dioksida, dan natrium klorida.
T: Apakah kalsium sulfit larut dalam air?
A: Ya, CaSO3 sedikit larut dalam air.
T: Apakah ada kalsium sulfit di air kota?
J: CaSO3 tidak umum ditemukan di air perkotaan, namun dapat digunakan dalam proses pengolahan air untuk menghilangkan kotoran.
Q: Bisakah CaSO3 dihilangkan dari air minum?
J: Ya, CaSO3 dapat dihilangkan dari air minum dengan berbagai metode seperti filtrasi, osmosis balik, atau pengolahan kimia.
Q: Apa yang dihasilkan CaSO3 dan HCl?
A: Ketika CaSO3 ditambahkan ke asam klorida, terjadi reaksi yang menghasilkan kalsium klorida, gas sulfur dioksida, dan air.
