Etanol atau C2H6O adalah alkohol tidak berwarna dan mudah terbakar yang berasal dari bahan tanaman, sering digunakan sebagai biofuel atau pelarut. Ini juga merupakan bahan umum dalam minuman beralkohol.
| Nama IUPAC | Etanol |
| Formula molekul | C2H6O |
| nomor CAS | 64-17-5 |
| Sinonim | Etil alkohol, alkohol gandum, EtOH, alkohol |
| Di ChI | InChI=1S/C2H6O/c1-2-3/h3H,2H2,1H3 |
Sifat etanol
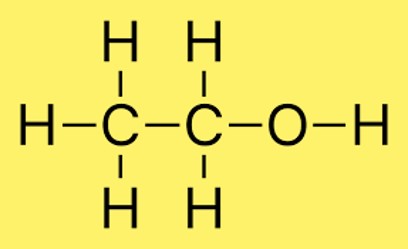
Struktur Lewis C2H6O
Struktur Lewis untuk C2H6O (juga dikenal sebagai etanol) dapat digambarkan sebagai berikut:
HH
| |
HCCOH
| |
HH
Dalam struktur ini, dua atom karbon dihubungkan satu sama lain melalui ikatan kovalen tunggal. Setiap atom karbon juga terikat pada tiga atom hidrogen dan satu atom karbon terikat pada satu atom oksigen. Atom oksigen terikat pada atom karbon melalui ikatan kovalen tunggal dan mempunyai dua pasang elektron bebas.
Struktur ini memenuhi aturan oktet, yang menyatakan bahwa setiap atom dalam molekul harus memiliki delapan elektron pada kulit valensinya. Atom karbon memiliki empat elektron pada kulit valensinya, sedangkan atom hidrogen masing-masing memiliki satu elektron. Atom oksigen memiliki enam elektron valensi dan, dengan dua pasangan elektron bebas tambahan, memenuhi aturan oktet.
C2H6O Massa Molar
Etanol memiliki massa molar sekitar 46,07 g/mol. Massa molar suatu zat didefinisikan sebagai massa satu mol zat tersebut. Dalam kasus etanol, satu mol etanol mengandung sekitar 46,07 gram zat tersebut. Massa molar adalah parameter yang berguna dalam perhitungan kimia karena memungkinkan konversi antara massa dan mol suatu zat.
Titik didih etanol
Etanol memiliki titik didih sekitar 78,5°C (173,3°F) pada tekanan standar. Titik didih yang relatif rendah ini memudahkan penguapan etanol, yang berguna dalam banyak proses industri. Misalnya, etanol biasa digunakan sebagai pelarut dalam produksi obat-obatan, parfum, dan bahan kimia lainnya.
Titik Leleh Etanol
Etanol memiliki titik leleh sekitar -114,1°C (-173,4°F). Titik leleh yang rendah ini membuat etanol berbentuk cair pada suhu kamar, oleh karena itu etanol biasa digunakan dalam bentuk cair sebagai pelarut atau bahan bakar. Titik leleh etanol lebih rendah dibandingkan air, sehingga etanol dapat digunakan sebagai antibeku dalam sistem pendingin mobil.
Kepadatan etanol g/mL
Massa jenis etanol kira-kira 0,789 g/mL pada suhu dan tekanan standar. Artinya satu mililiter etanol beratnya 0,789 gram. Massa jenis etanol lebih rendah dibandingkan air yang memiliki massa jenis 1 g/mL pada suhu dan tekanan standar. Artinya etanol akan mengapung di permukaan air.
Berat Molekul Etanol
Berat molekul etanol kira-kira 46,07 g/mol. Berat molekul adalah jumlah berat atom seluruh atom dalam suatu molekul. Dalam kasus etanol, ia mengandung dua atom karbon, enam atom hidrogen, dan satu atom oksigen. Berat molekul digunakan untuk menghitung jumlah mol suatu zat dalam massa zat tertentu.
Struktur etanol
Dalam struktur etanol, dua atom karbon terikat melalui satu ikatan dan tiga atom hidrogen terikat pada setiap atom karbon. Selain itu, atom hidrogen terikat pada atom oksigen. Susunan atom dalam molekul umumnya diwakili oleh CH3CH2OH.
rumus etanol
Rumus kimia etanol adalah C2H6O. Rumus ini menunjukkan jumlah dan jenis atom dalam molekul. Rumusnya dapat digunakan untuk menghitung berat molekul etanol, serta jumlah mol etanol dalam massa zat tertentu. Rumusnya juga berguna untuk memprediksi perilaku kimia etanol dalam reaksi dengan bahan kimia lainnya.
| Penampilan | Cairan tidak berwarna |
| Berat jenis | 0,789 |
| Warna | Tanpa warna |
| Bau | Bau khas |
| Masa molar | 46,07 g/mol |
| Kepadatan | 0,789 gram/ml |
| Titik fusi | -114,1°C (-173,4°F) |
| Titik didih | 78,5°C (173,3°F) pada tekanan standar |
| Titik kilat | 13°C (55°F) |
| Kelarutan dalam air | Dapat bercampur |
| Kelarutan | Larut dalam pelarut polar dan non-polar |
| Tekanan uap | 44,6 kPa pada 20°C |
| Kepadatan uap | 1,59 (udara = 1) |
| pKa | 15,9 hingga 25°C |
| pH | 7 (netral) |
Keamanan dan bahaya etanol
Etanol merupakan cairan yang mudah terbakar dan dapat menimbulkan bahaya kebakaran dan ledakan jika tidak ditangani dengan benar. Uap etanol juga mudah terbakar dan menimbulkan bahaya kebakaran yang serius. Etanol juga bisa berbahaya jika tertelan, dan konsumsi berlebihan bisa menyebabkan keracunan alkohol. Menghirup uap etanol dalam jumlah besar dapat menyebabkan pusing, sakit kepala, dan mual. Paparan etanol dalam waktu lama juga dapat menyebabkan iritasi dan kekeringan pada kulit. Etanol harus disimpan di tempat sejuk, berventilasi baik, jauh dari sumber api dan zat yang tidak kompatibel. Peralatan pelindung yang tepat, seperti sarung tangan dan kacamata pengaman, harus digunakan saat menangani etanol.
| Simbol bahaya | F, Xi, Flam. cair. 2 |
| Deskripsi Keamanan | Jauhkan dari panas, percikan api, nyala api terbuka, dan permukaan yang panas. DILARANG MEROKOK. Gunakan peralatan listrik, ventilasi, dan penerangan yang tahan ledakan. Hindari menghirup uap. Kenakan sarung tangan pelindung, kacamata pelindung. Jika terjadi kebakaran: Gunakan bubuk kimia kering, CO2, semprotan air atau busa untuk memadamkan. Buang isi/wadah sesuai dengan peraturan lokal/regional/nasional/internasional. |
| Sebuah pengidentifikasi | UN1170 |
| kode HS | 2207.10.00 |
| Kelas bahaya | 3 |
| Kelompok pengepakan | II |
| Toksisitas | Etanol dapat menjadi racun jika tertelan atau terhirup dalam jumlah banyak. Paparan yang terlalu lama juga dapat menyebabkan iritasi dan kekeringan pada kulit. Konsumsi kronis dapat menyebabkan alkoholisme dan masalah kesehatan lainnya. |
Metode sintesis etanol
Etanol dapat disintesis dengan berbagai metode, termasuk fermentasi, hidrasi etilen langsung, dan konversi biomassa.
Fermentasi adalah metode paling umum untuk memproduksi etanol dan melibatkan konversi gula dan karbohidrat lain menjadi etanol oleh mikroorganisme seperti ragi. Proses ini digunakan untuk memproduksi etanol dari tanaman seperti jagung, barley dan tebu, serta dari bahan limbah seperti sisa makanan dan sisa pertanian.
Hidrasi langsung etilen adalah metode lain untuk memproduksi etanol. Dalam proses ini, etilen bereaksi dengan air dengan adanya katalis seperti asam fosfat membentuk etanol. Metode ini umumnya digunakan dalam lingkungan industri dan lebih efisien dibandingkan fermentasi.
Konversi biomassa adalah metode lain untuk memproduksi etanol dan melibatkan konversi bahan tanaman seperti serpihan kayu, rumput, dan sisa pertanian menjadi etanol. Prosesnya melibatkan penguraian selulosa dan hemiselulosa dalam bahan tanaman menjadi gula sederhana yang dapat difermentasi menjadi etanol.
Metode lain untuk memproduksi etanol termasuk konversi karbon dioksida katalitik dan reduksi karbon dioksida elektrokimia.
Masing-masing metode ini memiliki kelebihan dan kekurangannya masing-masing, dan pemilihan metode bergantung pada faktor-faktor seperti ketersediaan bahan baku, biaya dan efektivitas. Fermentasi tetap menjadi metode produksi etanol yang paling banyak digunakan karena efektivitas biaya dan keandalannya.
Kegunaan etanol
Etanol memiliki berbagai kegunaan industri, komersial dan pribadi. Beberapa kegunaan umum meliputi:
- Etanol meningkatkan kadar oktan dan mengurangi emisi bila digunakan sebagai bahan tambahan bensin.
- Etanol adalah pelarut serbaguna yang biasa digunakan dalam produksi produk farmasi, kosmetik, dan perawatan pribadi.
- Minuman beralkohol seperti bir, anggur, dan minuman beralkohol mengandung etanol sebagai bahan aktifnya.
- Pembersih tangan, pembersih permukaan, dan produk pembersih lainnya menggunakan etanol sebagai disinfektan yang efektif.
- Etanol digunakan sebagai pelarut dalam ekstraksi minyak atsiri, perasa dan senyawa alami lainnya.
- Produsen menggunakan etanol sebagai bahan baku untuk produksi bahan kimia lainnya, seperti asam asetat dan etilen.
- Produk perawatan diri seperti parfum, lotion, dan produk perawatan rambut menggunakan etanol sebagai bahan pengawet dan pewangi.
- Laboratorium kimia umumnya menggunakan etanol sebagai pelarut dan reagen.
- Otomotif dan sistem pendingin lainnya mungkin menggunakan etanol sebagai bahan antibeku.
Pertanyaan:
Berapa banyak atom yang menyusun molekul etanol (C2H6O)?
Molekul etanol (C2H6O) terdiri dari 9 atom: 2 atom karbon, 6 atom hidrogen, dan 1 atom oksigen.
