Butana (C₄H₁₀) adalah gas hidrokarbon yang sangat mudah terbakar. Ini biasanya digunakan sebagai bahan bakar korek api dan kompor perkemahan karena sifat pembakarannya yang efisien dan mudah dibawa.
| Nama IUPAC | Butana |
| Formula molekul | C₄H₁₀ |
| nomor CAS | 106-97-8 |
| Sinonim | n-Butana, butil hidrida, metiletilmetana, dietil |
| Di ChI | InChI=1S/C4H10/c1-3-4-2/h3-4H2.1-2H3 |
Sifat butana
rumus butana
Rumus butana adalah C₄H₁₀, yang menunjukkan bahwa butana terdiri dari empat atom karbon dan sepuluh atom hidrogen. Rumusnya memberikan informasi berharga tentang komposisi kimia butana, sehingga memungkinkan para ilmuwan mempelajari sifat dan perilakunya.
Massa Molar Butana
Massa molar butil hidrida dapat dihitung dengan menjumlahkan massa atom unsur penyusunnya. Untuk butil hidrida (C₄H₁₀), massa molarnya kira-kira 58,12 gram per mol. Massa molar merupakan parameter penting dalam berbagai perhitungan kimia dan berperan penting dalam menentukan sifat fisik dan kimia butil hidrida.
Titik didih butana
Butil hidrida memiliki titik didih yang relatif rendah sekitar -1°C (30°F). Ini berarti bahwa pada atau di atas suhu ini, butil hidrida dengan mudah bertransisi dari fase cair ke fase gas. Titik didih yang rendah menjadikan butil hidrida bahan bakar ideal untuk aplikasi seperti korek api dan kompor kemah portabel.
Titik Leleh Butana
Titik leleh butil hidrida kira-kira -138,4°C (-217,12°F). Pada atau di bawah suhu ini, butil hidrida padat mengalami perubahan fasa dan menjadi cair. Namun, dalam kondisi atmosfer normal, butil hidrida umumnya ditemukan dalam bentuk gas.
Kepadatan butana g/mL
Kepadatan butil hidrida kira-kira 2,48 gram per mililiter. Hal ini menunjukkan butil hidrida lebih ringan dibandingkan air yang memiliki massa jenis 1 g/mL. Kepadatan butil hidrida merupakan sifat penting yang menentukan perilakunya selama penyimpanan atau transportasi, serta karakteristik pembakarannya.
Berat Molekul Butana
Berat molekul butil hidrida kira-kira 58,12 gram per mol. Ini mewakili jumlah berat atom semua atom dalam satu molekul butil hidrida. Berat molekul merupakan parameter penting untuk berbagai perhitungan ilmiah dan membantu memahami sifat dan perilaku butil hidrida.
Struktur butana
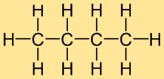
Struktur butil hidrida terdiri dari rantai lurus empat atom karbon, dimana sepuluh atom hidrogen terikat. Atom karbon tersusun dalam garis kontinu dan setiap atom karbon membentuk ikatan tunggal dengan dua atom karbon tetangga dan tiga atom hidrogen. Struktur linier ini berkontribusi terhadap sifat fisik dan kimia butil hidrida.
Kelarutan butana
Butil hidrida dianggap relatif tidak larut dalam air. Ia menunjukkan kelarutan yang rendah karena sifat nonpolarnya dan interaksi antarmolekul yang lemah dengan molekul air. Namun, butil hidrida sangat larut dalam pelarut organik seperti etanol dan aseton. Perilaku kelarutan ini penting dalam berbagai aplikasi, seperti proses ekstraksi dan reaksi berbasis pelarut.
| Penampilan | Gas tidak berwarna |
| Berat jenis | 2.48 |
| Warna | T/A |
| Bau | Tidak berbau |
| Masa molar | 58,12 g/mol |
| Kepadatan | 2,48g/ml |
| Titik fusi | -138,4°C (-217,12°F) |
| Titik didih | -1°C (30°F) |
| Titik kilat | -60°C (-76°F) |
| Kelarutan dalam air | Tidak larut |
| Kelarutan | Larut dalam pelarut organik |
| Tekanan uap | 2.4 ATM pada suhu 20°C |
| Kepadatan uap | 2,07 (udara = 1) |
| pKa | T/A |
| pH | T/A |
Keamanan dan Bahaya Butana
Butil hidrida menimbulkan risiko keamanan tertentu yang perlu dipertimbangkan. Ini adalah gas yang sangat mudah terbakar dan mudah terbakar jika ada sumber api. Tindakan pencegahan harus diambil untuk menghindari kebakaran atau ledakan yang tidak disengaja. Penting untuk menyimpan dan menangani butil hidrida di tempat yang berventilasi baik untuk menghindari akumulasi uap yang mudah terbakar. Menghirup butil hidrida secara langsung dapat berbahaya karena menggantikan oksigen dan menyebabkan sesak napas. Selain itu, paparan butil hidrida konsentrasi tinggi dapat menyebabkan pusing, mengantuk, dan mual. Penting untuk mengikuti tindakan pencegahan keselamatan yang tepat, seperti menggunakan butil hidrida pada peralatan yang dirancang dan disetujui dengan benar dan menghindari kontak dengan nyala api atau percikan api terbuka.
| Simbol bahaya | Gas mudah terbakar |
| Deskripsi Keamanan | Jauhkan dari nyala api terbuka dan percikan api. Simpan di tempat yang berventilasi baik. Hindari penghirupan dan kontak langsung. |
| Pengidentifikasi PBB | PBB 1011 |
| kode HS | 2711.12.20 |
| Kelas bahaya | Kelas 2.1 (Gas mudah terbakar) |
| Kelompok pengepakan | Kelompok pengepakan II |
| Toksisitas | Butil hidrida umumnya dianggap memiliki toksisitas rendah. Namun, jika terhirup dalam konsentrasi tinggi dapat menyebabkan pusing, mengantuk, dan mual. Hal ini juga dapat menggantikan oksigen di ruang tertutup, yang menyebabkan sesak napas. Prosedur ventilasi dan penanganan yang tepat harus diikuti untuk memastikan keselamatan. |
Metode Sintesis Butana
Berbagai metode mensintesis butil hidrida, terutama yang melibatkan produksi minyak bumi atau gas alam.
Distilasi Fraksional: Selama distilasi fraksional minyak mentah atau minyak bumi, prosesnya menghasilkan butil hidrida sebagai produk sampingan. Proses pemurnian memisahkan fraksi hidrokarbon yang berbeda berdasarkan titik didihnya, dan butil hidrida merupakan salah satu komponen yang dapat diisolasi.
Pemrosesan gas alam: Pemrosesan gas alam juga menghasilkan butil hidrida. Gas alam mengandung berbagai hidrokarbon, termasuk metana dan hidrokarbon tingkat tinggi seperti butil hidrida. Campuran gas alam mengalami proses seperti penyerapan atau pemisahan kriogenik untuk memisahkan butil hidrida.
Perengkahan hidrokarbon: Proses perengkahan memecah rantai hidrokarbon yang lebih besar menjadi rantai yang lebih kecil, menghasilkan butil hidrida. Hal ini melibatkan pemaparan hidrokarbon yang lebih berat pada suhu tinggi atau penggunaan katalis untuk menghasilkan butil hidrida sebagai produk.
Isomerisasi: Isomerisasi mengatur ulang struktur molekul hidrokarbon, memungkinkan sintesis butil hidrida dengan mengisomerisasi hidrokarbon lain seperti pentana atau heksana menjadi isomernya. Katalis spesifik mengkatalisis proses ini dalam kondisi yang sesuai.
Proses Sintesis: Di laboratorium, para ilmuwan dapat mensintesis butil hidrida melalui jalur sintetik. Mereka dapat menggunakan berbagai reaksi kimia, seperti hidrogenasi atau reduksi, untuk menghasilkan butil hidrida dari senyawa prekursor.
Metode ini memungkinkan produksi butil hidrida dalam proses industri skala besar maupun di laboratorium skala kecil. Pilihan metode tergantung pada ketersediaan bahan mentah, kemurnian yang diinginkan, dan persyaratan spesifik aplikasi.
Kegunaan Butana
Butil hidrida dapat diterapkan di berbagai industri dan penggunaan sehari-hari karena khasiatnya yang bermanfaat. Berikut beberapa kegunaan umum butil hidrida:
- Bahan Bakar: Butil hidrida menggerakkan kompor portabel, pemanas kamp, dan korek api sebagai bahan bakar, berkat kandungan energinya yang tinggi dan sifat pembakaran yang efisien.
- Propelan Aerosol: Butil hidrida mendorong produk aerosol seperti semprotan rambut, penyegar udara, dan cat aerosol, sehingga dapat dilepaskan sebagai kabut atau semprotan halus.
- Refrigeran: Butil hidrida mendinginkan dan mempertahankan suhu rendah dalam sistem pendingin skala kecil seperti lemari es dan freezer rumah tangga, berfungsi sebagai pendingin.
- Cairan Pemantik: Butil hidrida memberi daya pada pemantik rokok dan pemantik api, menghasilkan nyala api yang merupakan komponen kunci dari cairan pemantik api.
- Ekstraksi: Butil hidrida bertindak sebagai pelarut dalam ekstraksi minyak atsiri dan senyawa tumbuhan dari bahan tumbuhan, secara efektif melarutkan senyawa yang diinginkan.
- Penggunaan laboratorium: Laboratorium menggunakan butil hidrida sebagai bahan bakar pembakar Bunsen dan kromatografi gas.
- Gas kalibrasi: Butil hidrida berfungsi sebagai gas kalibrasi untuk detektor dan sensor gas, memberikan sifat yang terdefinisi dengan baik dan mudah diukur.
- Pengelasan dan penyolderan: Obor butil hidrida memudahkan operasi pengelasan dan penyolderan berkat suhunya yang tinggi, presisi, dan mudah digunakan.
- Rekreasi: Butil hidrida memberi daya pada kompor dan senter kemah portabel, meningkatkan aktivitas rekreasi luar ruangan seperti berkemah, hiking, dan memasak.
- Sumber Konsumsi: Butil hidrida berfungsi sebagai sumber panas dalam berbagai aplikasi, termasuk alat pemanas, pemanas kecil, dan aplikasi berbasis api di industri tertentu.
Sifat butil hidrida yang serba guna dan beragam aplikasinya menjadikannya senyawa yang berharga di beberapa industri, barang-barang rumah tangga, dan kegiatan rekreasi.
Pertanyaan:
T: Di mana saya bisa membeli gas butana di dekat saya?
J: Anda biasanya dapat menemukan gas butil hidrida di toko perkakas, supermarket, atau toko serba ada yang menjual perlengkapan berkemah.
T: Apakah gas butana merupakan gas alam?
J: Tidak, butil hidrida tidak dianggap sebagai gas alam. Ini adalah gas hidrokarbon yang berasal dari pengolahan minyak bumi atau gas alam.
T: Apa itu butana?
A: Butil hidrida adalah gas hidrokarbon dengan rumus kimia C₄H₁₀. Ini adalah gas mudah terbakar yang tidak berwarna dan tidak berbau yang biasa digunakan sebagai bahan bakar dan dalam berbagai aplikasi.
T: Bagaimana butana dibuat?
J: Butil hidrida terutama diproduksi melalui proses seperti distilasi fraksional minyak bumi atau gas alam, perengkahan hidrokarbon yang lebih berat, atau isomerisasi hidrokarbon lainnya.
T: Bagaimana cara mengisi ulang korek api butana?
A: Untuk mengisi korek api butil hidrida, pertama-tama cari katup isi ulang, biasanya di bagian bawah. Masukkan nosel butil hidrida ke dalam katup dan tekan dengan kuat untuk melepaskan butil hidrida ke dalam lumen hingga penuh.
Q: Manakah dari senyawa berikut yang merupakan isomer struktural butana?
J: Pentana (C₅H₁₂) adalah isomer struktural butil hidrida, karena kedua senyawa tersebut mengandung empat atom karbon tetapi memiliki susunan yang berbeda.
T: Bagaimana cara mengisi ulang korek api butana?
J: Untuk mengisi ulang korek api butil hidrida, pegang korek api secara terbalik, sejajarkan nosel kartrid isi ulang butil hidrida dengan katup isi ulang korek api dan tekan dengan kuat pada kartrid untuk melepaskan hidrida dari butil ke dalam korek api.
T: Di mana saya bisa membeli butana di dekat saya?
J: Anda dapat membeli butil hidrida di toko perkakas, supermarket, atau toko serba ada yang menjual perlengkapan berkemah atau perlengkapan rumah tangga.
T: Dimana bisa membeli butana?
J: Butil hidrida dapat dibeli dari berbagai sumber, termasuk pengecer online, toko perangkat keras, toko perlengkapan berkemah, dan beberapa supermarket.
Q: Pernyataan manakah yang paling tepat membandingkan titik leleh butana (C₄H₁₀) dengan titik leleh oktan (C₈H₁₈)?
A: Oktan, dengan struktur molekul yang lebih besar dan kompleks, umumnya memiliki titik leleh yang lebih tinggi dibandingkan butil hidrida.
Q: Berapa massa molar butana, C₄H₁₀?
A: Massa molar butil hidrida (C₄H₁₀) kira-kira 58,12 gram per mol.
Q: Berapa banyak isomer yang mungkin untuk C₄H₁₀?
A: Butil hidrida (C₄H₁₀) memiliki dua isomer: n-butana (butana normal) dan isobutana (2-metilpropana).
Q: Senyawa C₄H₁₀, SrCl₂, Cr(NO₃)₃, OF₂ manakah yang harus berbentuk molekul?
A: C₄H₁₀ (butil hidrida) dan OF₂ (oksigen difluorida) diperkirakan berbentuk molekul, sedangkan SrCl₂ dan Cr(NO₃)₃ merupakan senyawa ionik.
