Boron triklorida (BCl3) adalah senyawa yang terdiri dari tiga atom klor yang terikat pada satu atom boron. Ini digunakan dalam berbagai proses industri, seperti katalis dan sebagai reagen dalam sintesis organik.
| Nama IUPAC | Boron triklorida |
| Formula molekul | BCl3 |
| nomor CAS | 10294-34-5 |
| Sinonim | Trichloroborane; Boron(III) klorida, trikloro-boran, triklorobore |
| Di ChI | InChI=1S/BCl3/c2-1(3)4 |
Sifat boron triklorida
Rumus Boron Triklorida
Rumus boron klorida adalah BCl3, mewakili satu atom boron yang terikat pada tiga atom klor. Ini adalah rumus molekul sederhana dan mudah dipahami yang menggambarkan komposisi senyawa ini.
Massa Molar Boron Triklorida
Massa molar boron klorida dapat dihitung dengan menjumlahkan massa atom unsur penyusunnya. Boron memiliki massa atom sekitar 10,81 gram per mol dan setiap atom klor memiliki massa atom sekitar 35,45 gram per mol. Oleh karena itu, massa molar BCl3 kira-kira 117,17 gram per mol.
Titik didih boron triklorida
Boron klorida memiliki titik didih yang relatif rendah dibandingkan banyak senyawa lainnya. Mendidih pada suhu sekitar -15,7 derajat Celcius atau 3,77 derajat Fahrenheit. Artinya pada suhu di atas titik ini, boron klorida berubah dari fasa cair menjadi fasa gas.
Boron triklorida Titik lebur
Titik leleh boron klorida relatif rendah. Ia meleleh pada suhu sekitar -107,5 derajat Celcius atau -161,5 derajat Fahrenheit. Pada suhu di bawah titik ini, senyawa berubah dari wujud padat menjadi cair.
Massa jenis boron triklorida g/mL
Kepadatan boron klorida kira-kira 1,38 gram per mililiter. Nilai ini menunjukkan massa senyawa per satuan volume. Hal ini berguna untuk menentukan perilaku boron klorida dalam berbagai aplikasi dan memahami sifat fisiknya.
Berat Molekul Boron Triklorida
Berat molekul boron klorida kira-kira 117,17 gram per mol. Nilai ini mewakili jumlah massa atom seluruh atom dalam molekul senyawa dan berguna untuk berbagai perhitungan, seperti menentukan jumlah boron klorida dalam sampel tertentu.
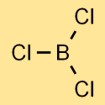
Struktur boron triklorida
Boron klorida memiliki struktur molekul trigonal planar. Terdiri dari atom boron di tengah yang terikat pada tiga atom klor, tersusun dalam bentuk segitiga. Struktur ini berkontribusi terhadap sifat fisik dan kimia senyawa.
Kelarutan boron triklorida
Boron klorida memiliki kelarutan yang rendah dalam air. Ia memiliki kelarutan yang buruk, artinya ia hanya larut sampai batas tertentu dalam larutan air. Namun, ia lebih larut dalam pelarut organik seperti benzena dan karbon tetraklorida. Kelarutan boron klorida mempengaruhi perilakunya dalam berbagai reaksi kimia dan proses industri.
| Penampilan | Gas tidak berwarna |
| Berat jenis | 1,369 gram/mL |
| Warna | Tanpa warna |
| Bau | hektar |
| Masa molar | 117,17 g/mol |
| Kepadatan | 1,38 gram/ml |
| Titik fusi | -107,5°C |
| Titik didih | -15,7°C |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Bereaksi |
| Kelarutan | Larut dalam pelarut organik seperti benzena dan karbon tetraklorida |
| Tekanan uap | 623 mmHg pada 20°C |
| Kepadatan uap | 3,24 (udara = 1) |
| pKa | Tak dapat diterapkan |
| pH | Tak dapat diterapkan |
Keamanan dan bahaya boron triklorida
Boron klorida menimbulkan beberapa pertimbangan keselamatan dan bahaya. Bahan ini bersifat korosif dan dapat menyebabkan luka bakar parah pada kulit, mata, dan saluran pernapasan jika bersentuhan. Menghirup uapnya dapat menyebabkan iritasi pernafasan dan kerusakan paru-paru. Senyawa ini juga sangat reaktif dengan air, melepaskan gas hidrogen klorida yang beracun. Penting untuk menangani boron klorida dengan hati-hati, menggunakan alat pelindung diri yang sesuai, dan memastikan ventilasi yang memadai. Jika terjadi paparan yang tidak disengaja, perhatian medis segera diperlukan. Selain itu, prosedur penyimpanan dan penanganan yang tepat harus diikuti untuk menghindari risiko kebakaran, ledakan, dan pelepasan gas berbahaya.
| Simbol bahaya | Korosif (C) |
| Deskripsi Keamanan | Kenakan sarung tangan pelindung/pelindung mata/pelindung wajah. Jangan menghirup debu/asap/gas/kabut/uap/semburan. Tangani di area yang berventilasi baik. |
| Nomor identifikasi PBB | UN1741 |
| kode HS | 2827390000 |
| Kelas bahaya | 8 (Zat korosif) |
| Kelompok pengepakan | II |
| Toksisitas | Sangat beracun jika tertelan atau terhirup. Dapat menyebabkan luka bakar parah dan iritasi pernafasan. Tangani dengan sangat hati-hati. |
Metode sintesis boron triklorida
Salah satu metode untuk mensintesis boron klorida melibatkan reaksi antara boron oksida (B2O3 ) dan karbon tetraklorida (CCl4) dengan adanya katalis seperti aluminium klorida (AlCl3) . B2O3 dan CCl4 bereaksi pada suhu tinggi, menghasilkan boron klorida dan karbon dioksida sebagai produk sampingan.
Pendekatan lain adalah reaksi langsung antara boron dan gas klor. Dalam kondisi terkendali, boron bereaksi dengan klorin, menghasilkan pembentukan boron klorida. Metode ini memerlukan penanganan gas klor yang hati-hati karena sifatnya yang berbahaya.
Tionil klorida (SOCl2) memungkinkan sintesis boron klorida dengan mereaksikan boron dengan SOCl2 pada suhu tinggi, menghasilkan produksi boron klorida dan gas sulfur dioksida.
Metode sintesis ini menawarkan jalur yang memungkinkan untuk pembuatan boron klorida, baik di laboratorium maupun di lingkungan industri. Penting untuk memastikan langkah-langkah keselamatan yang tepat selama sintesis, seperti bekerja di area yang berventilasi baik dan menggunakan peralatan pelindung yang sesuai. Hal ini penting karena sifat berbahaya dari reagen dan produk yang terlibat dalam proses tersebut.
Tuliskan kegunaan boron triklorida
Boron klorida banyak digunakan dalam katalisis, manufaktur semikonduktor, sintesis bahan, dan berbagai industri lainnya karena sifat kimianya yang unik dan keserbagunaannya.
- Boron klorida (BCl3) digunakan sebagai katalis dalam berbagai reaksi kimia, khususnya dalam sintesis organik. Ini memfasilitasi pembentukan ikatan karbon-karbon dan karbon-heteroatom dalam produksi obat-obatan, bahan kimia pertanian dan bahan kimia.
- BCl3 berfungsi sebagai reagen dalam sintesis polimer berbasis boron, seperti poliborazilena, yang memiliki aplikasi dalam pelapis tahan api dan suhu tinggi.
- BCl3 memfasilitasi produksi boron nitrida, bahan yang terkenal dengan stabilitas termal dan kimianya yang luar biasa, banyak digunakan dalam aplikasi suhu tinggi dan sebagai pelumas.
- Industri semikonduktor menggunakan BCl3 sebagai dopan untuk memasukkan atom boron ke dalam kristal silikon, meningkatkan sifat listriknya dan membuatnya cocok untuk digunakan pada perangkat elektronik.
- Dalam metalurgi, BCl3 bertindak sebagai zat fluks untuk menghilangkan pengotor oksida selama pemurnian logam, sehingga meningkatkan kemurniannya.
- BCl3 memainkan peran penting dalam pembuatan boron karbida, bahan ringan dan kuat yang banyak digunakan dalam produksi pelindung keramik dan alat pemotong.
- BCl3 memainkan peran penting dalam sintesis banyak senyawa yang mengandung boron, termasuk ester boron, asam boronat, dan boran. Senyawa ini mempunyai banyak aplikasi dalam penelitian kimia dan proses industri.
- Dalam industri perminyakan, BCl3 digunakan sebagai bahan tambahan untuk meningkatkan angka oktan bensin.
Ini berfungsi sebagai sumber boron dalam produksi kaca yang mengandung boron, yang memiliki sifat optik dan termal yang diinginkan.
Pertanyaan:
T: Apa rumus boron triklorida?
A: Rumus boron klorida adalah BCl3.
T: Apakah boron triklorida bersifat polar?
J: Ya, boron klorida adalah molekul polar karena adanya doublet bebas pada atom boron dan susunan atom klor yang asimetris.
T: Apa yang dimaksud dengan hibridisasi boron dalam boron triklorida (BCl3)?
A: Hibridisasi boron dalam BCl3 adalah sp2.
Q: Berapa massa molekul boron triklorida?
A: Massa molekul boron klorida (BCl3) kira-kira 117,17 gram per mol.
T: Apa yang dimaksud dengan hibridisasi boron triklorida?
A: Hibridisasi boron dalam boron klorida (BCl3) adalah sp2.
T: Apa yang terjadi jika Anda mencampurkan boron triklorida dan hidrogen?
A: Ketika boron klorida (BCl3) dicampur dengan hidrogen (H2), mereka bereaksi membentuk boron dan gas hidrogen klorida (HCl).
T: Mengapa boron triklorida berbentuk monomer sedangkan aluminium triklorida berbentuk dimer?
A: Perbedaan ukuran dan kerapatan elektron antara atom boron dan aluminium menyebabkan boron klorida (BCl3) ada sebagai monomer, sedangkan aluminium klorida (AlCl3) membentuk dimer karena kemampuannya membentuk ikatan koordinat.
Q: Apakah BCl3 merupakan asam Lewis?
J: Ya, BCl3 adalah asam Lewis karena dapat menerima pasangan elektron dari basa Lewis.
Q: Apakah BCl3 bersifat ionik atau kovalen?
A: BCl3 adalah senyawa kovalen.
Q: Apakah BCl3 merupakan ikatan kovalen?
J: Ya, BCl3 terdiri dari ikatan kovalen antara atom boron dan klor.
T: Apakah BCl3 termasuk gas?
A: Ya, BCl3 adalah gas suhu dan tekanan standar (STP).
Q: Apakah BCl3 merupakan molekul polar atau non-polar?
A: BCl3 adalah molekul polar karena distribusi kerapatan elektron yang tidak merata yang disebabkan oleh susunan atom klor yang asimetris di sekitar atom boron.
