Boron tribromida (BBr3) merupakan senyawa kimia yang digunakan sebagai katalis dalam berbagai reaksi. Ini terdiri dari satu atom boron dan tiga atom brom.
| Nama IUPAC | Boron tribromida |
| Formula molekul | BBr3 |
| nomor CAS | 10294-33-4 |
| Sinonim | Tribromoboran; Boron bromida; Boron(III) bromida; Bromobor; Boron tribromida, [B(Br)3]; Tribromo-boran |
| Di ChI | InChI=1S/3BrH.B/h3*1H;/q;;;+3/p-3 |
Sifat boron tribromida
Rumus Boron Tribromida
Rumus boron bromida adalah BBr3. Ini terdiri dari satu atom boron dan tiga atom brom. Senyawa kimia ini terbentuk dari kombinasi boron dan brom.
Massa Molar Boron Tribromida
Massa molar boron bromida (BBr3) dapat dihitung dengan menjumlahkan massa atom boron dan tiga atom brom. Boron memiliki massa atom sekitar 10,81 gram per mol dan brom memiliki massa atom sekitar 79,90 gram per mol. Jadi massa molar BBr3 kira-kira 250,60 gram per mol.
Titik didih boron tribromida
Boron bromida memiliki titik didih yang relatif rendah. Suhunya mulai mendidih sekitar 91 derajat Celsius (196 derajat Fahrenheit). Pada suhu tersebut senyawa mengalami perubahan fasa dari cair menjadi gas sehingga mengeluarkan uap BBr3.
Boron tribromida Titik lebur
Titik leleh boron bromida relatif tinggi. Ia mulai mencair sekitar -46 derajat Celsius (-51 derajat Fahrenheit). Pada suhu ini, senyawa padat berubah menjadi cair.
Kepadatan boron tribromida g/mL
Boron bromida memiliki kepadatan sekitar 2,63 gram per mililiter (g/mL). Massa jenis ini menunjukkan massa BBr3 yang terdapat dalam satu mililiter senyawa. Ini adalah ukuran kekompakan atau konsentrasi suatu zat.
Berat Molekul Boron Tribromida
Berat molekul boron bromida (BBr3) dihitung dengan menjumlahkan massa atom boron dan tiga atom brom. Berat molekul BBr3 kira-kira 250,60 gram per mol.
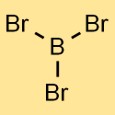
Struktur boron tribromida
Struktur boron bromida terdiri dari satu atom boron yang terikat pada tiga atom brom. Susunannya membentuk geometri trigonal planar, dimana atom boron berada di tengah dan ketiga atom brom tersebar merata di sekitarnya.
Kelarutan boron tribromida
Boron bromida adalah senyawa yang sangat reaktif dan umumnya sukar larut dalam air. Ia cenderung bereaksi dengan air membentuk asam hidrobromat dan asam borat. Namun BBr3 larut dalam pelarut organik seperti kloroform, karbon tetraklorida, dan karbon disulfida.
| Penampilan | Cairan tidak berwarna |
| Berat jenis | 2,63g/ml |
| Warna | Tanpa warna |
| Bau | hektar |
| Masa molar | 250,60 g/mol |
| Kepadatan | 2,63g/ml |
| Titik fusi | -46°C |
| Titik didih | 91°C |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Bereaksi |
| Kelarutan | Larut dalam pelarut organik seperti kloroform, CCl4 dan karbon disulfida |
| Tekanan uap | 78mmHg |
| Kepadatan uap | 6,52 (udara=1) |
| pKa | Tak dapat diterapkan |
| pH | Tak dapat diterapkan |
Keamanan dan bahaya boron tribromida
Boron bromida menimbulkan beberapa risiko keselamatan dan kehati-hatian harus dilakukan saat menangani senyawa ini. Ini bersifat korosif terhadap kulit, mata dan sistem pernapasan. Kontak langsung dapat menyebabkan luka bakar dan iritasi parah. Menghirup uapnya dapat menyebabkan ketidaknyamanan pernafasan. Ia bereaksi keras dengan air, mengeluarkan asap beracun. Oleh karena itu, penanganannya harus dilakukan di tempat yang berventilasi baik dan peralatan pelindung diri yang sesuai, seperti sarung tangan dan kacamata, harus dipakai. Itu harus disimpan jauh dari kelembaban dan zat yang tidak kompatibel. Jika terpapar, perhatian medis segera diperlukan. Protokol dan pedoman keselamatan yang tepat harus diikuti untuk meminimalkan risiko yang terkait dengan boron bromida.
| Simbol bahaya | Korosif, berbahaya bila basah |
| Deskripsi Keamanan | Hindari kontak dengan kulit, mata dan pakaian. Gunakan di area yang berventilasi baik. Kenakan sarung tangan dan kacamata pelindung. |
| Nomor identifikasi PBB | UN3264 |
| kode HS | 2811.19.9000 |
| Kelas bahaya | 8 |
| Kelompok pengepakan | II |
| Toksisitas | Beracun jika terhirup dan tertelan; menyebabkan luka bakar kulit yang parah dan kerusakan mata. |
Metode sintesis boron tribromida
Boron bromida dapat disintesis dengan berbagai metode. Metode yang umum melibatkan reaksi antara boron oksida (B2O3) dan brom (Br2). Reaksi berlangsung dengan adanya katalis, seperti karbon atau aluminium, pada suhu tinggi. Reaksi yang dihasilkan menghasilkan boron bromida dan melepaskan gas oksigen.
Metode lain melibatkan reaksi antara boron triklorida (BCl3) dan brom. Reaksi ini terjadi pada suhu kamar dan membentuk boron bromida dan gas klor sebagai produk sampingan.
Untuk menyiapkan boron bromida, boron dapat direaksikan dengan brom berlebih dalam lingkungan terkendali, memerlukan suhu tinggi dan pengendalian kondisi reaksi secara cermat.
Cara lain adalah dengan mensintesis boron bromida dengan mereaksikan boron hidrida, seperti diborana (B2H6) atau borana (BH3), dengan hidrogen bromida (HBr). Reaksi ini menghasilkan boron bromida dan gas hidrogen sebagai produk.
Perlu diingat bahwa metode sintesis ini memerlukan kehati-hatian karena sifat boron bromida yang sangat reaktif. Protokol keselamatan yang tepat, seperti memakai peralatan pelindung yang sesuai dan bekerja di area yang berventilasi baik, harus diikuti selama proses sintesis.
Kegunaan boron tribromida
Boron bromida (BBr3) memiliki beberapa kegunaan penting di berbagai industri. Berikut adalah beberapa aplikasi utama:
- Katalis: BBr3 secara aktif mengkatalisis reaksi sintesis organik, memungkinkan proses seperti reaksi asilasi, alkilasi, dan halogenasi.
- Bahan antara kimia: BBr3 bertindak sebagai prekursor dalam produksi senyawa boron lainnya, mensintesis reagen yang mengandung boron, asam boronat, dan polimer berbasis boron.
- Polimerisasi: BBr3 secara aktif berpartisipasi dalam reaksi polimerisasi, khususnya dalam produksi polimer seperti polietilen dan polipropilen, yang berfungsi sebagai katalis asam Lewis.
- Agen doping: Industri semikonduktor secara aktif menggunakan BBr3 sebagai agen doping, memodifikasi sifat listrik silikon agar sesuai dengan perangkat elektronik.
- Deteksi gas: BBr3 aktif bereaksi dengan gas tertentu seperti amonia, sehingga cocok untuk detektor gas dan sensor yang digunakan untuk tujuan deteksi dan pemantauan.
- Reagen Laboratorium: BBr3 aktif berfungsi sebagai reagen dalam berbagai percobaan dan penelitian laboratorium, melakukan reaksi brominasi dan berperan sebagai sumber atom bromin dalam kimia sintetik.
- Sintesis farmasi: Industri farmasi secara aktif menggunakan BBr3 dalam sintesis obat-obatan tertentu dan zat antara farmasi.
Penting untuk menangani boron bromida dengan hati-hati, mengikuti protokol keselamatan yang tepat, karena sifatnya yang korosif dan reaktif.
Pertanyaan:
T: Istilah apa yang menggambarkan reaktivitas boron tribromida (BBr3)?
J: Sangat responsif.
T: Apa rumus boron tribromida?
A: Rumus boron bromida adalah BBr3.
Q: Berapa jumlah atom boron dalam 3,24 gram boron tribromida?
J: Terdapat 0,053 mol BBr3 dalam 3,24 gram, yang setara dengan 0,159 mol boron, atau sekitar 9,62 x 10^22 atom.
Q: Berapa gram boron tribromida yang dapat dihasilkan dari 3,49 gram bromin?
A: Massa molar BBr3 adalah 250,60 g/mol. Jadi, sekitar 3,49 gram brom dapat menghasilkan sekitar 3,34 gram boron bromida.
Q: Apa nama senyawa yang rumusnya BBr3?
A: Senyawa dengan rumus BBr3 disebut boron bromida.
T: Apakah boron tribromida bersifat polar atau non-polar?
J: Boron bromida adalah senyawa polar.
T: Apa geometri elektronik BBr3?
A: Geometri elektronik BBr3 adalah trigonal planar.
Q: Apa struktur Lewis untuk BBr3?
J: Dalam struktur Lewis BBr3, terdapat atom boron di tengahnya yang dikelilingi oleh tiga atom brom.
Q: Berapa banyak puncak di BBr3?
J: Boron bromida (BBr3) mempunyai puncak pada spektrum NMRnya.
