Besi(III) hidroksida adalah senyawa yang terbentuk dari reaksi besi dengan air. Ini umumnya digunakan dalam obat-obatan, dalam pengolahan air dan sebagai pigmen dalam cat.
| Nama IUPAC | Besi(III) hidroksida |
| Formula molekul | Fe(OH)₃ |
| nomor CAS | 20344-49-4 |
| Sinonim | Besi hidroksida, besi trihidroksida, besi hidrat, besi (III) oksihidroksida |
| Di ChI | InChI=1S/Fe.3H2O/jam;3*1H2/q+3;;;/p-3 |
Sifat besi(III) hidroksida
Rumus besi(III) hidroksida
Rumus besi(III) hidroksida adalah Fe(OH)₃. Hal ini menunjukkan bahwa setiap molekul Fe(OH)₃ terdiri dari satu atom Fe yang terikat pada tiga ion OH.
Besi(III) Hidroksida Massa Molar
Massa molar Fe(OH)₃ dapat dihitung dengan menjumlahkan massa atom unsur-unsur penyusunnya. Besi memiliki massa molar 55,845 g/mol dan setiap ion hidroksida (OH) memiliki massa molar 17,007 g/mol. Oleh karena itu, massa molar Fe(OH)₃ kira-kira 106,867 g/mol.
Titik didih besi(III) hidroksida
Fe(OH)₃ tidak memiliki titik didih yang jelas karena ia terurai sebelum mencapai titik didihnya. Sebaliknya, ia mengalami dekomposisi termal untuk membentuk besi(III) oksida dan air ketika dipanaskan.
Titik lebur besi(III) hidroksida
Fe(OH)₃ juga terurai jika dipanaskan dan tidak memiliki titik leleh yang jelas. Ia berubah menjadi besi(III) oksida dan air pada suhu tinggi.
Massa jenis besi (III) hidroksida g/mL
Massa jenis Fe(OH)₃ bergantung pada berbagai faktor seperti keadaan fisiknya (padat atau larutan) dan konsentrasinya. Massa jenis Fe(OH)₃ dalam bentuk padat adalah sekitar 3,4 g/mL.
Berat Molekul Besi(III) Hidroksida
Berat molekul Fe(OH)₃ dihitung dengan menjumlahkan berat atom atom penyusunnya. Berat molekul Fe(OH)₃ adalah sekitar 106,867 g/mol.
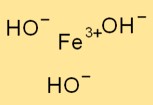
Struktur besi(III) hidroksida
Fe(OH)₃ mengadopsi struktur trigonal, di mana atom besi dikelilingi oleh tiga ion hidroksida. Atom besi bertindak sebagai atom pusat dan ion hidroksida dihubungkan dengannya melalui ikatan ionik.
Kelarutan besi(III) hidroksida
Fe(OH)₃ memiliki kelarutan yang terbatas dalam air. Ia membentuk endapan ketika dilarutkan dalam air dan kelarutannya bergantung pada berbagai faktor seperti suhu, pH dan keberadaan ion lain. Kelarutan Fe(OH)₃ meningkat dalam kondisi asam.
| Penampilan | Coklat pekat |
| Berat jenis | 3.4 |
| Warna | Cokelat |
| Bau | Tidak berbau |
| Masa molar | 106,867 g/mol |
| Kepadatan | 3,4 gram/ml |
| Titik fusi | Terurai |
| Titik didih | Terurai |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Tidak larut |
| Kelarutan | Tidak larut. Tergantung pada faktor-faktor seperti suhu, pH dan keberadaan ion lainnya |
| Tekanan uap | Dapat diabaikan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | Sekitar 5-7 |
Keamanan dan Bahaya Besi(III) Hidroksida
Fe(OH)₃ menimbulkan pertimbangan keamanan dan bahaya tertentu. Umumnya dianggap memiliki toksisitas rendah. Namun, jika tertelan atau terhirup dalam jumlah besar dapat menyebabkan iritasi gastrointestinal dan ketidaknyamanan pernapasan. Penting untuk menghindari kontak dengan mata dan kulit, karena dapat menyebabkan iritasi. Jika terjadi kontak, bilas area yang terkena dengan banyak air. Saat menangani Fe(OH)₃, disarankan untuk memakai peralatan pelindung yang sesuai, seperti sarung tangan dan kacamata, untuk meminimalkan risiko paparan. Ventilasi yang memadai harus dipastikan untuk menghindari penumpukan debu. Selain itu, penting untuk mengikuti tindakan pencegahan keselamatan dan menangani Fe(OH)₃ dengan hati-hati untuk meminimalkan potensi risiko.
| Simbol bahaya | Tidak ada |
| Deskripsi Keamanan | – Hindari kontak dengan mata dan kulit <br> – Kenakan peralatan pelindung <br> – Pastikan ventilasi yang memadai |
| Nomor identifikasi PBB | Tak dapat diterapkan |
| kode HS | 2821.10.0000 |
| Kelas bahaya | Tidak diklasifikasikan |
| Kelompok pengepakan | Tak dapat diterapkan |
| Toksisitas | Toksisitas rendah |
Metode sintesis besi (III) hidroksida
Ada berbagai metode untuk mensintesis Fe(OH)₃. Metode yang umum digunakan melibatkan reaksi pengendapan antara garam besi dan basa. Misalnya, dengan menambahkan larutan besi klorida (FeCl₃) ke dalam larutan natrium hidroksida (NaOH) , Fe(OH)₃ dapat terbentuk. Reaksinya terjadi sebagai berikut:
FeCl₃ + 3NaOH → Fe(OH)₃ + 3NaCl
Dalam metode lain, besi(II) hidroksida dapat dioksidasi menjadi Fe(OH)₃ dengan memaparkannya ke udara atau mengolahnya dengan zat pengoksidasi. Reaksinya terjadi sebagai berikut:
4Fe(OH)₂ + O₂ → 2Fe(OH)₃
Selain itu, Fe(OH)₃ dapat dibuat dengan menghidrolisis larutan garam besi. Proses ini melibatkan penambahan air ke dalam larutan garam besi, sehingga terbentuk endapan Fe(OH)₃. Reaksinya terjadi sebagai berikut:
FeCl₃ + 3H₂O → Fe(OH)₃ + 3HCl
Metode sintesis ini menyediakan cara untuk memperoleh Fe(OH)₃ untuk berbagai aplikasi, termasuk farmasi, pengolahan air, dan sebagai pigmen pada cat. Penting untuk mengikuti tindakan pencegahan keselamatan yang tepat dan menangani bahan kimia secara bertanggung jawab selama proses sintesis.
Kegunaan Besi(III) Hidroksida
Fe(OH)₃ memiliki beberapa aplikasi karena sifatnya yang unik. Berikut beberapa kegunaan umum Fe(OH)₃:
- Industri farmasi: Industri farmasi menggunakan Fe(OH)₃ dalam produksi suplemen zat besi dan obat-obatan, seperti yang digunakan untuk mengobati anemia defisiensi besi.
- Pengolahan Air: Proses pengolahan air menggunakan Fe(OH)₃ untuk menghilangkan kontaminan dan kotoran. Fe(OH)₃ bertindak sebagai flokulan, membantu menggumpalkan dan menghilangkan partikel tersuspensi dalam air.
- Pigmen dalam cat: Fe(OH)₃, dengan warna coklatnya, dapat digunakan sebagai pigmen dalam cat, pelapis dan pewarna. Ini memberikan beragam warna alami dan sangat berguna untuk menghasilkan warna oker dan sienna.
- Pengolahan Air Limbah: Instalasi pengolahan air limbah menggunakan Fe(OH)₃ untuk menghilangkan fosfat dan kontaminan logam berat dari air limbah industri.
- Katalisis: Fe(OH)₃ bertindak sebagai katalis dalam berbagai reaksi kimia, termasuk dekomposisi hidrogen peroksida dan reaksi oksidasi.
- Adsorben: Fe(OH)₃ berfungsi sebagai bahan adsorben untuk menghilangkan kotoran, kontaminan dan pewarna dari larutan.
- Amandemen tanah: Fe(OH)₃ bertindak sebagai amandemen tanah untuk meningkatkan kesuburan tanah dan ketersediaan unsur hara. Ini meningkatkan kapasitas tanah menahan unsur hara dan menyediakan zat besi penting untuk pertumbuhan tanaman.
- Reagen Laboratorium: Di laboratorium, peneliti dan analis menggunakan Fe(OH)₃ sebagai reagen untuk berbagai tujuan analitik dan penelitian, termasuk reaksi pengendapan dan penyesuaian pH.
Penerapan Fe(OH)₃ yang serba guna menyoroti pentingnya Fe(OH)₃ dalam berbagai industri dan kontribusinya terhadap berbagai proses mulai dari farmasi hingga sanitasi lingkungan.
Pertanyaan:
Q: Berapa berat yang tepat untuk rumus besi(III) hidroksida?
A: Berat formula Fe(OH)₃ yang benar adalah sekitar 106,867 g/mol.
Q: Apa persamaan ionik lengkap untuk reaksi antara FeBr3 dan barium hidroksida?
A: Persamaan ionik lengkap untuk reaksi antara FeBr3 dan barium hidroksida adalah FeBr₃ + 3Ba(OH)₂ → 3BaBr₂ + Fe(OH)₃.
Q: Berapa massa endapan besi(III) hidroksida yang dapat dihasilkan dengan mereaksikan 75,0 mL?
A: Untuk menentukan massa endapan Fe(OH)₃, diperlukan informasi tambahan seperti konsentrasi atau molaritas reaktan.
T: Bagaimana cara membentuk besi(III) hidroksida?
A: Fe(OH)₃ dapat dibentuk dengan berbagai metode, termasuk reaksi pengendapan antara garam besi dan basa, oksidasi Fe(OH)2, atau hidrolisis larutan garam besi.
T: Apakah besi(III) hidroksida larut?
A: Tidak, Fe(OH)₃ tidak larut dalam air. Ini membentuk endapan ketika dilarutkan dalam air.
Q: Berapa gram Fe(OH)₃ dalam 4,61 gram Fe³⁺?
A: Untuk menentukan gram Fe(OH)₃, diperlukan massa molar Fe³⁺ dan stoikiometri reaksi.
Q: Apa warna Fe(OH)₃?
A: Fe(OH)₃ umumnya berwarna coklat.
T: Apakah besi hidroksida berbentuk padat?
J: Ya, besi hidroksida ada dalam bentuk padat.
T: Apa yang dihasilkan oleh besi hidroksida yang terdekomposisi secara termal?
A: Fe(OH)₃ yang terurai secara termal menghasilkan besi(III) oksida (Fe₂O₃) dan air.
T: Apakah besi hidroksida larut dalam air?
J: Tidak, besi hidroksida tidak larut dalam air. Ini membentuk endapan ketika dicampur dengan air.
