Sulfur diklorida (SCl₂) adalah senyawa kimia yang dibentuk dengan menggabungkan belerang dan klor. Ini digunakan di berbagai industri untuk membuat pewarna, karet dan pestisida.
| Nama IUPAC | Sulfur diklorida |
| Formula molekul | SCl₂ |
| nomor CAS | 10545-99-0 |
| Sinonim | Klorin monosulfida, sulfur klorida, sulfur diklorida, sulfur klorida, diklorosulfan |
| Di ChI | InChI=1S/Cl2S/c1-3-2 |
Sifat belerang diklorida
Rumus belerang diklorida
Rumus sulfur klorida adalah SCl₂. Ini mewakili kombinasi satu atom belerang dan dua atom klor. Rumus kimia ini secara akurat mencerminkan komposisi dan struktur senyawa.
Massa Molar Sulfur Diklorida
Massa molar belerang klorida dapat dihitung dengan menjumlahkan massa atom unsur-unsur penyusunnya. Belerang memiliki massa molar 32,06 g/mol dan klor memiliki massa molar 35,45 g/mol. Dengan menambahkan massa dua atom klor dan satu atom belerang, massa molar belerang klorida ditentukan menjadi sekitar 102,91 g/mol.
Titik didih belerang diklorida
Sulfur klorida memiliki titik didih 138,8°C (281,8°F). Suhu ini menunjukkan titik di mana senyawa cair berubah menjadi gas pada tekanan atmosfer standar. Penting untuk mempertimbangkan titik didih sulfur klorida saat menangani atau menggunakannya dalam berbagai aplikasi.
Sulfur diklorida Titik lebur
Titik leleh sulfur klorida adalah -76,8°C (-106,2°F). Suhu ini mewakili titik di mana senyawa padat berubah menjadi cair. Mengetahui titik leleh sangat penting saat menangani sulfur klorida untuk memastikan penanganan dan penyimpanan yang tepat.
Kepadatan sulfur diklorida g/mL
Sulfur klorida memiliki kepadatan sekitar 1,64 g/mL. Nilai massa jenis menunjukkan jumlah massa per satuan volume suatu zat. Sifat ini penting untuk memahami perilaku dan karakteristik sulfur klorida dalam berbagai konteks, seperti selama reaksi kimia atau untuk menentukan kesesuaiannya untuk aplikasi tertentu.
Berat Molekul Sulfur Diklorida
Berat molekul belerang klorida kira-kira 102,91 g/mol. Ini mewakili massa total molekul suatu senyawa, dihitung dengan menambahkan massa atom unsur-unsur penyusunnya. Berat molekul memberikan informasi berharga tentang massa senyawa dan memungkinkan pengukuran yang tepat dalam berbagai perhitungan kimia.
Struktur belerang diklorida
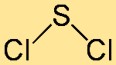
Struktur belerang klorida paling baik digambarkan sebagai molekul melengkung atau berbentuk V. Ini terdiri dari atom belerang pusat yang terikat pada dua atom klor. Susunan atom dan sudut ikatannya berkontribusi terhadap stabilitas dan reaktivitas senyawa secara keseluruhan.
Kelarutan sulfur diklorida
Sulfur klorida memiliki kelarutan terbatas dalam air. Ini sulit larut dan cenderung membentuk larutan keruh bila dicampur dengan air. Karakteristik kelarutan suatu senyawa penting untuk dipertimbangkan ketika menentukan kompatibilitasnya dengan zat lain dan perilakunya dalam pelarut yang berbeda.
| Penampilan | Cairan kuning |
| Berat jenis | 1,64 gram/ml |
| Warna | KUNING |
| Bau | hektar |
| Masa molar | 102,91 g/mol |
| Kepadatan | 1,64 gram/ml |
| Titik fusi | -76,8°C |
| Titik didih | 138,8°C |
| Titik kilat | Tidak tersedia |
| Kelarutan dalam air | Bereaksi |
| Kelarutan | Larut dalam asam asetat glasial, benzena, brom |
| Tekanan uap | 35,4 mmHg |
| Kepadatan uap | 3,9 (udara=1) |
| pKa | Tidak tersedia |
| pH | Tidak tersedia |
Keamanan dan bahaya sulfur diklorida
Sulfur klorida menimbulkan beberapa risiko keselamatan dan harus ditangani dengan hati-hati. Bahan ini sangat korosif dan dapat menyebabkan luka bakar parah jika terkena kulit, mata, atau selaput lendir. Menghirup uapnya dapat mengiritasi sistem pernapasan dan menyebabkan batuk, kesulitan bernapas, dan kerusakan paru-paru. Bahan ini juga mudah terbakar dan dapat terbakar jika ada zat tertentu. Saat bekerja dengan sulfur klorida, peralatan pelindung yang sesuai seperti sarung tangan, kacamata dan pelindung pernapasan harus digunakan. Penting untuk menangani dan menyimpan senyawa ini di tempat yang berventilasi baik, jauh dari sumber api dan bahan yang tidak kompatibel, untuk menghindari kecelakaan dan potensi kerusakan.
| Simbol bahaya | Korosif |
| Deskripsi Keamanan | Hindari kontak, kenakan alat pelindung, bekerja di tempat yang berventilasi baik |
| Nomor identifikasi PBB | Sebuah tahun 1828 |
| kode HS | 2812.10.00 |
| Kelas bahaya | 8 (Zat korosif) |
| Kelompok pengepakan | II |
| Toksisitas | Sangat beracun |
Metode sintesis sulfur diklorida
Ada beberapa metode untuk mensintesis sulfur klorida. Pendekatan yang umum melibatkan reaksi antara sulfur dan gas klor. Dalam proses ini, kelebihan klorin muncul saat sulfur dipanaskan hingga suhu tertentu, biasanya sekitar 200-250°C (392-482°F). Reaksi berlanjut untuk membentuk sulfur klorida.
Metode lain melibatkan reaksi antara tionil klorida (SOCl₂) dan belerang. Tionil klorida bertindak sebagai sumber klorin, yang bereaksi dengan belerang menghasilkan belerang klorida. Reaksi ini terjadi pada suhu yang relatif lebih rendah dibandingkan metode sulfur-klorin langsung.
Reaksi antara sulfuril klorida (SO₂Cl₂) dan hidrogen sulfida (H₂S) memungkinkan pembuatan sulfur klorida. Reaksi ini terjadi pada suhu tinggi dan menghasilkan sulfur klorida dan produk sampingan lainnya.
Untuk menjamin keselamatan personel yang terlibat, penting untuk melakukan sintesis sulfur klorida di laboratorium atau lingkungan industri yang lengkap. Personil harus mengikuti tindakan pencegahan keselamatan yang tepat, termasuk mengenakan peralatan pelindung dan bekerja di area yang berventilasi baik, karena sifat berbahaya dari senyawa tersebut.
Pilihan metode sintesis bergantung pada berbagai faktor, termasuk ketersediaan bahan baku, kemurnian produk yang diinginkan, dan persyaratan aplikasi spesifik. Pemilihan teknik yang tepat bergantung pada kebutuhan spesifik proses atau aplikasi, karena setiap metode memiliki kelebihan dan pertimbangan tersendiri.
Kegunaan sulfur diklorida
Sulfur klorida (SCl₂) dapat diterapkan di berbagai industri dan proses karena sifat spesifiknya. Berikut beberapa kegunaan utama sulfur klorida:
- Manufaktur Pewarna: Produsen menggunakan sulfur klorida untuk menghasilkan pewarna, khususnya pewarna belerang, yang memberikan warna cerah pada kain di industri tekstil.
- Industri Karet: Industri karet menggunakan SCl₂ sebagai bahan vulkanisir untuk meningkatkan kekuatan dan elastisitas produk karet melalui ikatan silang rantai polimer.
- Sintesis pestisida: Sulfur klorida memainkan peran penting dalam sintesis pestisida tertentu, memungkinkan produksi insektisida dan fungisida yang disebut senyawa organofosfat dan organotiofosfat.
- Sintesis kimia: SCl₂ berfungsi sebagai reagen serbaguna dalam berbagai reaksi kimia, memungkinkan reaksi klorinasi seperti konversi alkohol menjadi alkil klorida atau sintesis senyawa organik terklorinasi.
- Reagen Laboratorium: Laboratorium menggunakan sulfur klorida sebagai reagen untuk berbagai aplikasi, termasuk sintesis organik, kimia sulfur, dan reaksi anorganik.
- Pengolahan Air: Proses pengolahan air menggunakan SCl₂ sebagai disinfektan dan zat pengoksidasi untuk menghilangkan mikroorganisme berbahaya dan polutan organik dari sumber air.
- Industri farmasi: Sulfur klorida digunakan dalam penelitian dan pengembangan farmasi, khususnya dalam sintesis bahan aktif farmasi (API) tertentu.
- Analisis kimia: Teknik kimia analitik, seperti kromatografi gas, menggunakan SCl₂ untuk mendeteksi dan menganalisis senyawa tertentu.
Berbagai penerapan ini menyoroti pentingnya sulfur klorida dalam berbagai proses industri dan upaya ilmiah. Namun, penting untuk menangani dan menggunakan sulfur klorida dengan hati-hati, mengikuti pedoman dan prosedur keselamatan yang tepat karena sifatnya yang berbahaya.
Pertanyaan:
Q: Apa rumus sulfur diklorida?
A: Rumus sulfur klorida adalah SCl₂.
T: Rumus apa yang mewakili senyawa molekul sulfur diklorida?
A: Senyawa molekuler sulfur klorida dinyatakan dengan rumus SCl₂.
T: Apakah belerang diklorida bersifat polar?
J: Ya, sulfur klorida bersifat polar karena adanya geometri molekul yang melengkung dan distribusi kerapatan elektron yang tidak merata.
Q: Orbital atom atau hibrid manakah yang membentuk ikatan sigma antara S dan Cl dalam sulfur diklorida, SCl₂?
A: Ikatan sigma antara belerang (S) dan klor (Cl) dalam belerang klorida (SCl₂) terbentuk oleh tumpang tindih orbital 3p belerang dan orbital 3p klor.
T: Apakah SCl₂ linier?
J: Tidak, sulfur klorida (SCl₂) tidak linier. Ia memiliki geometri molekul melengkung atau berbentuk V.
Q: Manakah dari senyawa berikut yang merupakan senyawa ionik? Cl₂O, CH₂O, SCl₂, PF₅, Mg₃(PO₄)₂.
J: Tidak satu pun senyawa yang terdaftar merupakan senyawa ionik. Ini bisa berupa senyawa molekuler (Cl₂O, CH₂O, SCl₂, PF₅) atau senyawa fosfat anorganik (Mg₃(PO₄)₂).
Q: Apa nama senyawa yang mempunyai rumus SCl₂?
A: Senyawa dengan rumus SCl₂ disebut sulfur klorida.
Q: Apa bentuk SCl₂?
A: SCl₂ memiliki bentuk molekul melengkung atau berbentuk V.
Q: Apa geometri molekul SCl₂?
A: Geometri molekul SCl₂ melengkung atau berbentuk V.
Q: Apa nama orbital hibrid yang digunakan belerang di SCl₂?
A: Atom belerang pada SCl₂ menggunakan orbital hibrid sp².
Q: Apa yang terjadi jika satu atom belerang bergabung dengan dua atom klor menghasilkan SCl₂?
A: Ketika satu atom belerang bergabung dengan dua atom klor, ia membentuk senyawa SCl₂, yang dikenal sebagai belerang klorida. Atom belerang berbagi elektron dengan atom klor untuk menciptakan ikatan kovalen di antara keduanya.
