Barium nitrat (Ba(NO3)2) berbentuk padatan berwarna putih. Ini larut dalam air dan membentuk ion barium dan nitrat. Ini bisa meledak jika dipanaskan atau dicampur dengan bahan bakar.
| Nama IUPAC | Barium dinitrat |
| Formula molekul | Ba(NO3)2 |
| nomor CAS | 10022-31-8 |
| Sinonim | Barium nitrat, Bariumdinitrat, Barium dinitrat, CQ9625000, (nitrooksi)bario nitrat |
| Di ChI | InChI=1S/Ba.2NO3/c;2 2-1(3)4/q+2;2 -1 |
Sifat barium nitrat
Formula Barium Nitrat
Rumus molekul barium nitrat adalah Ba(NO3)2. Hal ini menunjukkan bahwa molekul barium nitrat terdiri dari satu atom barium dan dua molekul nitrat. Ion nitrat bermuatan -1 dan ion barium bermuatan +2, sehingga perbandingannya 1:2 membentuk senyawa netral.
Massa Molar Barium Nitrat
Massa molar Ba(NO3)2 adalah 261,337 g/mol. Ini adalah massa satu mol molekul Ba(NO3)2. Untuk menghitungnya, Anda harus menjumlahkan massa atom semua atom dalam rumus:
Massa molar Ba(NO3)2 = (1 x 137,327) + (2 x 14,007) + (6 x 15,999) = 261,337 g/mol
Titik didih barium nitrat
Titik didih Ba(NO3)2 adalah 83°C. Ini adalah suhu di mana Ba(NO3)2 berubah dari wujud cair menjadi gas. Namun Ba(NO3)2 terurai sebelum mencapai titik didihnya, sehingga tidak mungkin mendidih tanpa terurai menjadi zat lain.
Barium nitrat Titik lebur
Titik leleh Ba(NO3)2 adalah 592°C. Ini adalah suhu di mana Ba(NO3)2 berubah dari padat menjadi cair. Ba(NO3)2 berbentuk padatan kristal putih pada suhu dan tekanan kamar, tetapi meleleh jika dipanaskan melebihi titik lelehnya.
Massa jenis barium nitrat g/ml
Massa jenis Ba(NO3)2 adalah 3,23 g/ml. Ini adalah massa per satuan volume Ba(NO3)2. Untuk menghitungnya, Anda harus membagi massa sampel Ba(NO3)2 dengan volumenya:
Massa jenis Ba(NO3)2 = Massa/Volume
Misalnya, jika kita mempunyai 10 g sampel Ba(NO3)2 dan volumenya 3,1 ml, maka massa jenisnya adalah:
Massa jenis Ba(NO3)2 = 10 / 3,1 = 3,23 g/ml
Berat Molekul Barium Nitrat
Berat molekul Ba(NO3)2 sama dengan massa molarnya, yaitu 261,337 g/mol. Ini adalah massa satu mol molekul Ba(NO3)2. Terkadang istilah berat molekul digunakan secara bergantian dengan massa molar, namun keduanya tidak persis sama. Berat molekul mengacu pada massa rata-rata suatu molekul suatu zat, sedangkan massa molar mengacu pada massa satu mol suatu zat.
Struktur barium nitrat
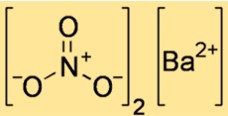
Struktur Ba(NO3)2 menunjukkan bagaimana atom dan ion tersusun dalam ruang. Ba(NO3)2 merupakan senyawa ionik, artinya terdiri dari ion barium bermuatan positif dan ion nitrat bermuatan negatif yang diikat oleh gaya elektrostatis. Struktur Ba(NO3)2 dapat direpresentasikan dengan sel satuan, yaitu satuan berulang terkecil yang menunjukkan susunan ion-ion dalam kisi kristal.
Sel satuan Ba(NO3)2 berbentuk kubik, dengan ion barium di setiap sudut dan ion nitrat di tengah setiap permukaannya. Bilangan koordinasi setiap ion adalah enam, artinya setiap ion dikelilingi oleh enam ion yang bermuatan berlawanan. Panjang setiap tepi sel satuan adalah 0,65 nm.
Kelarutan barium nitrat
Kelarutan Ba(NO3)2 adalah jumlah Ba(NO3)2 yang dapat larut dalam sejumlah pelarut tertentu, biasanya air. Kelarutan bergantung pada beberapa faktor, seperti suhu, tekanan dan keberadaan zat lain dalam larutan.
Pada suhu 20°C dan tekanan atmosfer, kelarutan Ba(NO3)2 dalam air kira-kira 34 g per 100 ml. Artinya 34 g Ba(NO3)2 dapat larut dalam 100 ml air pada kondisi tersebut. Kelarutan meningkat dengan meningkatnya suhu dan menurun dengan meningkatnya tekanan.
Ba(NO3)2 juga larut dalam pelarut lain, seperti etanol, aseton, dan metanol, tetapi kurang larut dibandingkan dalam air.
| Penampilan | Padatan putih |
| Kepadatan spesifik | 3.23 |
| Warna | Tidak berwarna, perak atau abu-abu |
| Bau | Tidak berbau |
| Masa molar | 261,337 g/mol |
| Kepadatan | 3,23 gram/ml |
| Titik fusi | 592°C |
| Titik didih | 83°C |
| Titik kilat | Tidak mudah terbakar |
| Kelarutan dalam air | 34 g per 100 ml pada 20°C |
| Kelarutan | Larut dalam etanol, aseton dan metanol; tidak larut dalam eter dan kloroform |
| Tekanan uap | Dapat diabaikan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | Tidak tersedia |
Keamanan dan bahaya barium nitrat
Ba(NO3)2 merupakan zat beracun dan pengoksidasi. Ini dapat membahayakan Anda jika Anda menelan atau menghirupnya. Hal ini dapat mengiritasi mata, kulit, dan sistem pernapasan. Ba(NO3)2 juga dapat menyebabkan kejang otot, gangguan jantung, dan kematian. Anda harus menghindari kontak dengan Ba(NO3)2 dan memakai alat pelindung saat menanganinya. Anda juga harus menjauhkannya dari panas, percikan api, nyala api, dan bahan yang mudah terbakar. Jika Anda terpapar Ba(NO3)2, Anda harus membilas mata dan kulit Anda dengan air dan mencari pertolongan medis. Anda juga dapat mengonsumsi garam sulfat untuk mengurangi toksisitas barium.
| Simbol bahaya | O (oksidan), Xn (berbahaya) |
| Deskripsi Keamanan | S13: Jauhkan dari makanan dan minuman, termasuk yang berasal dari hewan. S17: Jauhkan dari bahan yang mudah terbakar. S22: Jangan menghirup debu. S26: Jika kena mata, segera bilas dengan banyak air dan konsultasikan ke dokter. S36/37/39: Kenakan pakaian pelindung, sarung tangan, dan pelindung mata/wajah yang sesuai. |
| Nomor identifikasi PBB | UN1446 |
| kode HS | 2834 29 10 |
| Kelas bahaya | 5.1 (Bahan pengoksidasi) |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | LD50 (oral, tikus) = 355 mg/kg; LC50 (inhalasi, tikus) = 0,15 mg/L/4 jam |
Metode sintesis barium nitrat
Berbagai metode dapat digunakan untuk membuat Ba(NO3)2, yang merupakan zat padat berwarna putih.
Salah satu metode melibatkan mereaksikan barium karbonat dengan asam nitrat . Ini menghasilkan Ba(NO3)2 dan karbon dioksida. Saring larutan Ba(NO3)2 untuk menghilangkan pengotor besi, kemudian evaporasi hingga diperoleh kristal padat.
Metode lain adalah dengan mereaksikan barium sulfida dengan asam nitrat . Ini menghasilkan Ba(NO3)2 dan hidrogen sulfida. Untuk memurnikan dan mengkristalkan larutan Ba(NO3)2, kami mengikuti proses yang sama seperti sebelumnya.
Metode ketiga melibatkan pelarutan logam barium atau barium oksida dalam asam nitrat . Ini menghasilkan Ba(NO3)2 dan hidrogen atau air. Larutan yang mengandung Ba(NO3)2 kemudian dipekatkan dan mengalami kristalisasi.
Metode keempat adalah dengan menggunakan sintesis garam cair. Proses ini melibatkan pemanasan campuran Ba(NO3)2 dan bahan pengawet anorganik, seperti amonium klorida, natrium bikarbonat, atau natrium nitrit. Vesicant memecah dan menciptakan pori-pori pada kristal Ba(NO3)2. Hal ini membuat mereka lebih dapat diandalkan sebagai pengoksidasi piroteknik.
Berikut beberapa metode sintesis Ba(NO3)2. Mereka semua menggunakan asam nitrat sebagai reaktan umum dan menghasilkan Ba(NO3)2 sebagai produk.
Kegunaan Barium Nitrat
Beberapa kegunaan Ba(NO3)2 adalah:
- Senyawa Barium Oksida – Digunakan dalam produksi bahan yang mengandung barium oksida, seperti keramik, kaca, dan tabung sinar katoda.
- Api Hijau – Digunakan pada lampu lalu lintas hijau dan kembang api karena menyala dengan nyala hijau akibat emisi ion barium.
- Rodentisida – Digunakan sebagai rodentisida untuk membunuh tikus dan mencit, karena beracun bagi mereka.
- Pengoksidasi – Digunakan dalam detonator dan bahan peledak, ini adalah oksidan kuat yang dapat meningkatkan pembakaran zat lain.
- Primer – Digunakan dalam peluru primer dan pelacak karena memberikan penyalaan dan visibilitas amunisi.
- Pigmen – Digunakan dalam pembuatan cat dan pigmen karena dapat memberi warna putih atau hijau.
- Agen Pengoksidasi – Digunakan sebagai agen pengoksidasi dalam berbagai reaksi kimia, seperti sintesis barium peroksida dan barium hidroksida.
- Bahan Peledak – Digunakan dalam pembuatan bahan peledak seperti Baratol, yang merupakan campuran Ba(NO3)2, TNT dan bahan pengikat.
Pertanyaan:
T: Apakah barium nitrat larut?
A: Ba(NO3)2 larut dalam air dan beberapa pelarut lain, seperti etanol, aseton, dan metanol.
T: Apakah barium nitrat berguna untuk beton?
A: Ba(NO3)2 tidak berguna untuk beton, karena dapat menyebabkan korosi pada tulangan baja dan retak pada beton.
Q: Apakah akan terbentuk endapan jika larutan kalium sulfat dan barium nitrat digabungkan?
A: Ya, endapan barium sulfat (BaSO4) akan terbentuk jika larutan kalium sulfat (K2SO4) dan barium nitrat (Ba(NO3)2) digabungkan.
Q: Barium nitrat memiliki rumus Ba(NO3)2. Manakah pernyataan yang benar tentang barium nitrat?
J: Salah satu pernyataan yang mungkin adalah: Ba(NO3)2 adalah senyawa ionik yang terdiri dari satu ion barium dan dua ion nitrat.
T: Apakah barium nitrat mudah menguap?
A: Tidak, Ba(NO3)2 tidak mudah menguap karena memiliki titik leleh yang tinggi dan terurai sebelum mendidih.
T: Apakah barium nitrat netral?
J: Tidak, Ba(NO3)2 tidak netral, karena merupakan garam asam yang dapat menurunkan pH suatu larutan.
Q: Apa yang dihasilkan dari reaksi penggantian Ba(NO3)2 dan Na2SO4?
A: NaNO3 dan BaSO4 dihasilkan selama reaksi penggantian Ba(NO3)2 dan Na2SO4.
Q: Apakah Ba(NO3)2 larut dalam air?
A: Ya, Ba(NO3)2 larut dalam air, karena larut membentuk ion barium dan ion nitrat.
Q: Apa persamaan ionik bersih untuk reaksi MgSO4 dengan Ba(NO3)2?
A: Persamaan ionik bersih untuk reaksi MgSO4 dengan Ba(NO3)2 adalah:
Ba2+ + SO42- → BaSO4
Q: Berapa mol dalam 432 g Ba(NO3)2?
A: Banyaknya mol dalam 432 g Ba(NO3)2 adalah:
n = m/M, n = 432/261,337, n = 1,653 mol
Q: Apakah Ba(NO3)2 dapat larut?
A: Ya, Ba(NO3)2 bersifat larut, karena larut membentuk ion barium dan ion nitrat.
