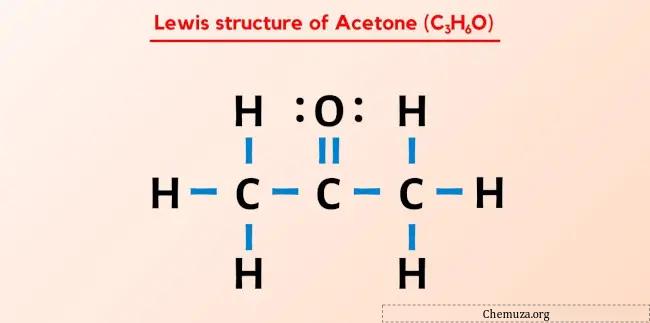
Struktur Lewis aseton (juga dikenal sebagai propanon atau C3H6O) memiliki tiga atom karbon (C) berturut-turut, yang memiliki atom oksigen (O) yang terikat ganda pada atom karbon (C) pusat) dan tiga atom hidrogen (H) tunggal yang terikat. pada setiap atom karbon (C) terluar. Terdapat 2 pasangan elektron bebas pada atom oksigen (O).
Mari kita pahami struktur Lewis aseton dengan langkah sederhana.
Langkah-Langkah Menggambar Struktur Lewis Aseton (C3H6O)
Langkah 1: Temukan jumlah total elektron valensi dalam molekul C3H6O
Untuk mengetahui jumlah total elektron valensi dalam molekul C3H6O, pertama-tama Anda perlu mengetahui elektron valensi yang ada pada atom karbon , atom hidrogen, dan atom oksigen.
(Elektron valensi adalah elektron yang ada di orbit terluar atom mana pun.)
Di sini saya akan memberi tahu Anda cara mudah mencari elektron valensi karbon, hidrogen, dan oksigen menggunakan tabel periodik.
Total elektron valensi dalam molekul C3H6O
→ Elektron valensi diberikan oleh atom karbon:
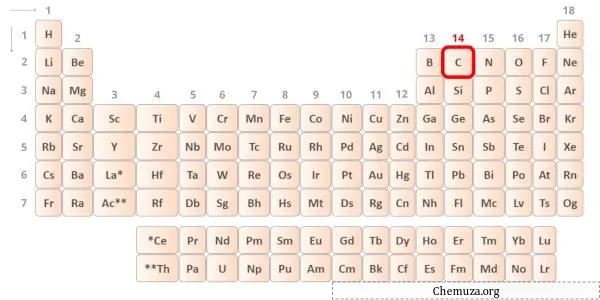
Karbon adalah unsur dalam golongan 14 tabel periodik. [1] Oleh karena itu, elektron valensi yang ada dalam karbon adalah 4 .
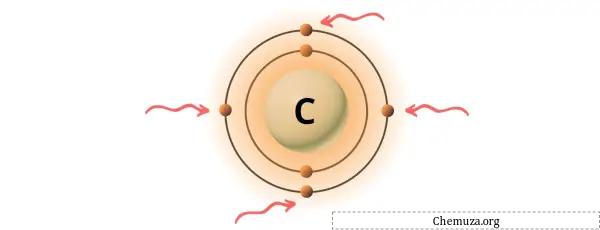
Anda dapat melihat 4 elektron valensi yang ada pada atom karbon seperti terlihat pada gambar di atas.
→ Elektron valensi diberikan oleh atom hidrogen:
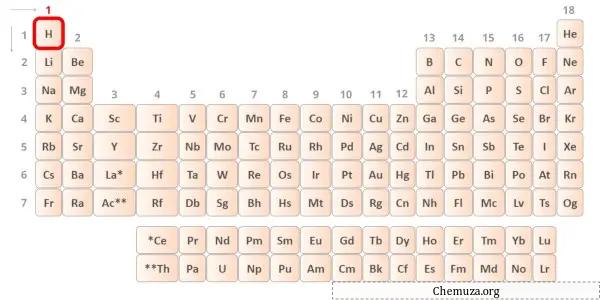
Hidrogen adalah unsur golongan 1 dalam tabel periodik.[2] Oleh karena itu, elektron valensi yang ada dalam hidrogen adalah 1 .

Anda dapat melihat bahwa hanya ada satu elektron valensi dalam atom hidrogen seperti yang ditunjukkan pada gambar di atas.
→ Elektron valensi diberikan oleh atom oksigen:

Oksigen adalah unsur dalam golongan 16 tabel periodik. [3] Oleh karena itu, elektron valensi yang ada dalam oksigen adalah 6 .
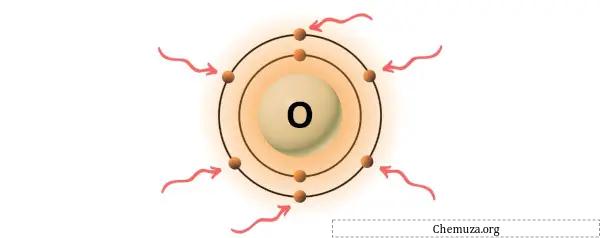
Anda dapat melihat 6 elektron valensi yang ada pada atom oksigen seperti terlihat pada gambar di atas.
Jadi,
Jumlah elektron valensi dalam molekul C3H6O = elektron valensi yang disumbangkan oleh 3 atom karbon + elektron valensi yang disumbangkan oleh 6 atom hidrogen + elektron valensi yang disumbangkan oleh 1 atom oksigen = 4(3) + 1(6) + 6 = 24 .
Langkah 2: Siapkan sketsa
Struktur Lewis aseton memiliki tiga atom karbon berturut-turut dengan atom oksigen terikat pada atom karbon pusat. Atom hidrogen terikat pada dua atom karbon terluar. Atom oksigen terikat ganda pada atom karbon sedangkan atom hidrogen terikat tunggal pada atom karbon.
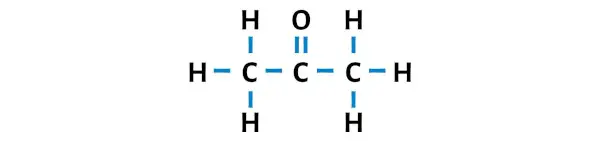
Langkah 3: Jadikan atom luar stabil
Di sini, pada sketsa molekul C3H6O, Anda dapat melihat bahwa atom terluar adalah atom hidrogen dan atom oksigen.
Atom hidrogen stabil karena mempunyai 2 elektron (karena hidrogen hanya memerlukan 2 elektron untuk membentuk duplet stabil).
Jadi sekarang mari kita buat atom oksigen stabil dengan membentuk oktet di atasnya.
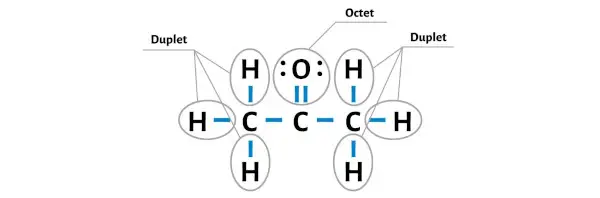
Anda sekarang dapat melihat bahwa semua atom eksternal stabil.
Selain itu, pada langkah 1, kami menghitung jumlah total elektron valensi yang ada dalam molekul C3H6O.
Molekul C3H6O memiliki total 24 elektron valensi dan semua elektron valensi ini digunakan dalam diagram C3H6O di atas.
Oleh karena itu, struktur Lewis C3H6O (atau aseton) di atas adalah struktur yang stabil.
Semoga Anda memahami langkah-langkah di atas.
Untuk lebih banyak latihan dan pemahaman yang lebih baik, Anda dapat mencoba struktur Lewis lainnya yang tercantum di bawah.
Cobalah (atau setidaknya lihat) struktur Lewis ini untuk pemahaman yang lebih baik:
