Asam nitrat (HNO3) adalah asam anorganik yang kuat dan sangat reaktif. Ini digunakan dalam pupuk, bahan peledak dan dalam industri pencelupan dan percetakan tekstil. Ia juga membentuk nitrat, yang memainkan peran penting dalam proses biologis dan reaksi pembakaran.
| Nama IUPAC | Asam sendawa |
| Formula molekul | HNO3 |
| nomor CAS | 7697-37-2 |
| Sinonim | Aqua fortis, Semangat nitre, Asam nitrat |
| Di ChI | InChI=1S/HNO3/c2-1(3)4 |
Sifat asam nitrat
Massa Molar Asam Nitrat
Massa molar asam nitrat adalah 63,01 g/mol. Ini adalah jumlah zat yang mengandung jumlah entitas yang sama (seperti atom, molekul, atau ion) seperti dalam 12 gram karbon-12 murni.
Formula Asam Nitrat
Rumus kimia asam nitrat adalah HNO<sub>3</sub>. Ini mewakili jumlah dan jenis atom dalam molekul. Rumusnya dapat digunakan untuk memprediksi sifat fisik dan kimianya, seperti titik didih, titik leleh, dan massa jenis.
Titik didih asam nitrat
Titik didih asam nitrat adalah 83,0°C (181,4°F). Ini adalah suhu di mana suatu zat berubah dari cair menjadi gas pada tekanan tertentu. Asam nitrat adalah zat yang sangat reaktif dan mudah menguap, dan titik didih membantu menentukan kondisi penanganan dan penyimpanannya.
Titik leleh asam nitrat
Titik leleh asam nitrat adalah -41,5°C (-42,7°F). Ini adalah suhu di mana zat padat berubah wujud menjadi cair. Titik leleh asam nitrat yang rendah membuatnya mudah ditangani dalam bentuk cair.
Massa jenis asam nitrat g/ml
Massa jenis asam nitrat adalah 1,51 g/mL. Ini adalah ukuran jumlah massa per satuan volume suatu zat. Kepadatan asam nitrat dapat membantu menentukan persyaratan penyimpanan dan penanganannya, serta potensinya untuk bereaksi dengan zat lain.
Berat Molekul Asam Nitrat
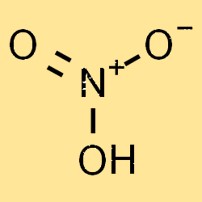
Berat molekul asam nitrat adalah 63,01 g/mol. Ini adalah jumlah berat atom dari masing-masing atom dalam molekul. Berat molekul asam nitrat merupakan faktor penting dalam menentukan sifat fisik dan kimianya.
Struktur asam nitrat
Asam nitrat adalah cairan tidak berwarna, sangat reaktif dan mudah menguap. Struktur molekulnya terdiri dari satu atom nitrogen, satu atom hidrogen, dan tiga atom oksigen, sehingga membentuk rumus kimia HNO3. Atom oksigen tersusun dalam susunan trigonal planar di sekitar atom nitrogen.
| Penampilan | Cairan tidak berwarna |
| Berat jenis | 1,51 gram/ml |
| Warna | Tanpa warna |
| Bau | Bau yang menyengat dan menyengat |
| Masa molar | 63,01 g/mol |
| Kepadatan | 1,51 gram/ml |
| Titik fusi | -41,5°C (-42,7°F) |
| Titik didih | 83,0°C (181,4°F) |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Dapat bercampur |
| Kelarutan | Larut dalam alkohol, eter dan pelarut polar lainnya |
| Tekanan uap | Dibesarkan pada suhu kamar |
| Kepadatan uap | 1,48 (udara = 1) |
| pKa | -1.3 |
| pH | 1 (larutan 10%) |
Catatan: Titik nyala asam nitrat tidak berlaku karena berbentuk cair. PH larutan asam nitrat 10% adalah 1, yang menunjukkan bahwa larutan tersebut merupakan asam kuat. PKa adalah logaritma negatif dari konstanta disosiasi asam, yang merupakan ukuran kekuatan asam dalam larutan.
Keamanan dan bahaya asam nitrat
Asam nitrat adalah zat yang sangat reaktif dan korosif yang dapat menyebabkan cedera serius atau kematian jika tidak ditangani dengan benar. Hal ini dapat menyebabkan luka bakar, kerusakan mata, dan iritasi pernafasan. Peralatan pelindung yang sesuai, seperti sarung tangan dan kacamata, harus dipakai saat menangani asam nitrat. Area penyimpanan harus memiliki ventilasi yang baik dan tumpahan harus segera dibersihkan untuk mencegah keluarnya asap beracun. Jika terjadi kontak dengan kulit atau mata, bilas area yang terkena dengan air setidaknya selama 20 menit dan segera dapatkan bantuan medis.
| Simbol bahaya | Berbahaya bagi lingkungan, Pengoksidasi, Berbahaya, Mengiritasi |
| Deskripsi Keamanan | S2 – Jauhkan dari jangkauan anak-anak. S23 – Jangan menghirup asap. S24/25 – Hindari kontak dengan kulit dan mata. S26 – Jika kena mata, segera bilas dengan banyak air dan konsultasikan dengan dokter. |
| Nomor identifikasi PBB | PBB 2031 |
| kode HS | 2811.90.90 |
| Kelas bahaya | 8 |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | Sangat beracun jika tertelan dan terhirup. Dapat menyebabkan luka bakar parah dan kerusakan mata, serta iritasi pernafasan. |
Metode sintesis asam nitrat
Asam nitrat dapat disintesis dengan beberapa metode, antara lain:
- Proses Ostwald: Metode ini melibatkan oksidasi amonia dengan udara untuk membentuk oksida nitrat, yang kemudian dioksidasi menjadi asam nitrat.
- Nitrasi Toluena: Metode ini melibatkan nitrasi toluena untuk membentuk nitro-toluena, yang kemudian dioksidasi menjadi asam nitrat.
- Dekomposisi termal amonium nitrat: Metode ini melibatkan pemanasan amonium nitrat untuk menghasilkan oksida nitrat, yang kemudian dioksidasi menjadi asam nitrat.
- Oksidasi Langsung Amonia : Metode ini melibatkan oksidasi langsung amonia dengan oksigen untuk menghasilkan asam nitrat.
- Elektrolisis Natrium Nitrat: Metode ini melibatkan elektrolisis natrium nitrat untuk menghasilkan asam nitrat.
Metode-metode ini bervariasi dalam efektivitas, biaya, dan dampak lingkungan, dan pilihan metode bergantung pada penggunaan akhir yang diinginkan dan skala produksi.
Kegunaan Asam Nitrat
Asam nitrat memiliki kegunaan yang luas di berbagai industri, antara lain:
- Pupuk: Asam nitrat digunakan dalam produksi pupuk nitrogen, seperti amonium nitrat dan garam asam nitrat.
- Farmasi: Asam nitrat digunakan sebagai reagen dalam produksi obat-obatan dan zat antara kimia lainnya.
- Bahan peledak: Asam nitrat digunakan dalam produksi bahan peledak, seperti dinamit dan nitroselulosa.
- Pengolahan Logam: Asam nitrat digunakan untuk pengawetan, pembersihan, dan pengetsaan logam, termasuk baja, tembaga, dan aluminium.
- Pencelupan dan Pencetakan: Digunakan sebagai mordan dalam proses pencelupan dan pencetakan.
- Pengolahan Air: Asam nitrat digunakan dalam pengolahan air untuk mengontrol tingkat pH dan menghilangkan kotoran.
- Penelitian dan pengembangan: Asam nitrat digunakan sebagai reagen laboratorium untuk berbagai reaksi dan analisis kimia.
Secara keseluruhan, asam nitrat memiliki beragam aplikasi karena sifat asam dan pengoksidasinya, menjadikannya bahan kimia penting dalam berbagai proses industri.
Pertanyaan:
Apakah asam nitrat termasuk asam kuat atau asam lemah?
Ya, asam nitrat (HNO3) termasuk asam kuat. Asam kuat terdisosiasi sempurna dalam air menghasilkan ion hidrogen (H+), yang berarti asam kuat terionisasi sempurna. Sebaliknya, asam lemah hanya terionisasi sebagian dalam air, artinya asam lemah tidak terdisosiasi sempurna.
Dalam larutan asam nitrat, hampir setiap molekul menyumbangkan ion hidrogen, menjadikannya donor proton yang kuat. Akibatnya, asam nitrat memiliki konsentrasi ion hidrogen yang tinggi dan pH yang rendah, biasanya sekitar 1-2. Kekuatan suatu asam ditentukan oleh kemampuannya mendonorkan ion hidrogen dan asam nitrat merupakan salah satu asam terkuat dalam daftar asam kuat.
Perlu diperhatikan bahwa asam nitrat (HNO3) memiliki efek oksidasi yang kuat dan menimbulkan risiko luka bakar serius dan reaksi kimia. Tangani asam nitrat dengan hati-hati dan kenakan peralatan pelindung yang sesuai.
