Asam klorosulfonat adalah asam kuat dengan rumus HSO₃Cl. Ini sangat korosif, digunakan sebagai reagen dalam sintesis organik dan sebagai zat sulfonasi untuk pembuatan deterjen dan pewarna.
| Nama IUPAC | Asam klorosulfonat |
| Formula molekul | HSO₃Cl |
| nomor CAS | 7790-94-5 |
| Sinonim | Klorohidrin sulfat, asam klorosulfat, asam klorosulfonat |
| Di ChI | InChI=1S/ClHO3S/c1-5(2,3)4/jam(H,2,3,4) |
Sifat asam klorosulfonat
Rumus asam klorosulfonat
Rumus asam klorosulfonat adalah HSO₃Cl. Terdiri dari satu atom hidrogen, satu atom belerang, tiga atom oksigen, dan satu atom klor.
Massa Molar Asam Klorosulfonat
Massa molar asam klorosulfat dihitung dengan menjumlahkan massa atom atom penyusunnya. Massa molar HSO₃Cl kira-kira 116,5 gram per mol.
Titik didih asam klorosulfonat
Titik didih asam klorosulfat relatif tinggi. Suhunya sekitar 151 derajat Celcius (304 derajat Fahrenheit). Pada suhu ini, asam klorosulfat berubah dari fase cair menjadi fase gas.
Titik lebur asam klorosulfonat
Asam klorosulfat memiliki titik leleh sekitar -82 derajat Celsius (-116 derajat Fahrenheit). Ini adalah suhu di mana bentuk padat asam klorosulfat berubah menjadi cair.
Massa jenis asam klorosulfonat g/mL
Asam klorosulfat memiliki kepadatan sekitar 1,75 gram per mililiter (g/mL) pada suhu kamar. Ini berarti bahwa volume asam klorosulfat tertentu relatif berat dibandingkan dengan volume air yang sama.
Berat Molekul Asam Klorosulfonat
Berat molekul asam klorosulfat dihitung dengan menjumlahkan berat atom semua atom dalam rumus kimianya. Asam klorosulfat memiliki berat molekul sekitar 116,5 gram per mol.
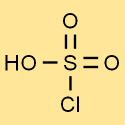
Struktur asam klorosulfonat
Struktur asam klorosulfat terdiri dari satu atom belerang yang terikat pada tiga atom oksigen dan satu atom klor. Atom hidrogen terikat pada salah satu atom oksigen. Struktur ini memberi asam klorosulfat sifat dan reaktivitasnya yang unik.
Kelarutan asam klorosulfonat
Asam klorosulfat sangat larut dalam air. Ini mudah larut dalam air, membentuk larutan asam kuat. Kelarutan asam klorosulfat disebabkan oleh sifat polarnya dan pembentukan ikatan hidrogen dengan molekul air.
| Penampilan | Cairan tidak berwarna sampai kuning |
| Berat jenis | 1,75 (pada 20°C) |
| Warna | Tidak berwarna sampai kuning |
| Bau | Bau yang kuat dan menyengat |
| Masa molar | 116,5 g/mol |
| Kepadatan | 1,75 g/mL (pada 20°C) |
| Titik fusi | -82°C (-116°F) |
| Titik didih | 151°C (304°F) |
| Titik kilat | Tidak tersedia |
| Kelarutan dalam air | Dapat bercampur |
| Kelarutan | Larut dalam pelarut organik seperti kloroform, diklorometana, nitrobenzena |
| Tekanan uap | Tidak tersedia |
| Kepadatan uap | Tidak tersedia |
| pKa | -2.6 |
| pH | Sangat asam (pH <1) |
Catatan: Harap diingat bahwa nilai yang diberikan dalam tabel ini adalah sifat umum yang terkait dengan asam klorosulfat. Nilai sebenarnya mungkin sedikit berbeda tergantung pada kondisi spesifik dan kemurnian senyawa.
Keamanan dan bahaya asam klorosulfonat
Asam klorosulfat menimbulkan risiko keamanan yang signifikan dan harus ditangani dengan sangat hati-hati. Bahan ini sangat korosif dan dapat menyebabkan luka bakar parah jika terkena kulit, mata, dan sistem pernapasan. Menghirup atau menelan dapat menyebabkan risiko kesehatan yang serius termasuk gangguan pernapasan dan kerusakan organ dalam. Ia bereaksi hebat dengan air, melepaskan gas beracun dan menghasilkan panas. Risiko kebakaran dan ledakan terjadi jika bersentuhan dengan bahan organik. Peralatan pelindung diri yang memadai, seperti sarung tangan, kacamata dan respirator, harus digunakan saat bekerja dengan asam klorosulfat. Ventilasi dan tindakan pengendalian yang tepat sangat penting untuk meminimalkan paparan dan memastikan keselamatan saat menangani zat berbahaya ini.
| Simbol bahaya | Korosif (C), Berbahaya (Xn) |
| Deskripsi Keamanan | – Tangani dengan sangat hati-hati\n- Gunakan peralatan pelindung yang sesuai\n- Hindari kontak dengan kulit, mata, dan pernafasan\n- Simpan di tempat yang berventilasi baik\n- Jangan campur dengan air atau zat reaktif |
| Nomor identifikasi PBB | PBB 1751 |
| kode HS | 28121100 |
| Kelas bahaya | Kelas 8 – Zat korosif |
| Kelompok pengepakan | Kelompok pengepakan II |
| Toksisitas | Sangat beracun; menyebabkan luka bakar parah dan kerusakan pernafasan |
Metode sintesis asam klorosulfonat
Ada beberapa metode untuk mensintesis asam klorosulfat. Metode yang umum melibatkan reaksi antara sulfur trioksida (SO₃) dan hidrogen klorida (HCl) . Dalam proses ini, larutan HCl digelembungkan dengan gas SO₃ untuk menghasilkan asam klorosulfat. Kontrol suhu dan kondisi reaksi yang cermat diperlukan karena tingginya eksotermisitas reaksi.
Dalam metode lain, reaksi gas klor (Cl₂) dengan asam sulfat (H₂SO₄) menghasilkan asam klorosulfat. Aliran gas klor melalui asam sulfat pekat menghasilkan pembentukan asam klorosulfat. Untuk memastikan keamanan, Anda harus mengambil tindakan yang tepat terhadap reaksi eksotermik ini.
Selain itu, pembuatan asam klorosulfat melibatkan reaksi asam sulfat dengan sulfuril klorida (SO₂Cl₂). Sulfuril klorida bereaksi dengan asam sulfat membentuk asam klorosulfat dan gas hidrogen klorida.
Perlu dicatat bahwa sintesis asam klorosulfat harus dilakukan di laboratorium yang lengkap, dengan mengikuti protokol keselamatan yang sesuai. Ahli kimia harus menggunakan peralatan pelindung, seperti sarung tangan, kacamata dan tudung, untuk memastikan keamanannya.
Metode sintesis ini memungkinkan ahli kimia untuk menghasilkan asam klorosulfat, senyawa serbaguna yang digunakan dalam berbagai aplikasi industri, termasuk sintesis organik, reaksi sulfonasi, dan produksi pewarna dan deterjen.
Kegunaan Asam Klorosulfonat
Asam klorosulfat banyak digunakan di berbagai industri karena sifatnya yang serba guna. Berikut beberapa kegunaannya:
- Asam klorosulfat secara aktif berpartisipasi dalam berbagai reaksi sintesis organik, termasuk esterifikasi, sulfonasi, dan halogenasi, yang berfungsi sebagai reagen kuat. Ini secara efisien memperkenalkan kelompok fungsional dan memodifikasi struktur molekul.
- Dalam pembuatan pewarna, asam klorosulfat memainkan peran penting karena secara aktif mensulfonasi senyawa aromatik, sehingga memungkinkan terciptanya gugus asam sulfonat. Kelompok-kelompok ini meningkatkan kelarutan pewarna dan meningkatkan sifat warna.
- Dalam produksi deterjen, asam klorosulfat aktif berfungsi sebagai zat sulfonasi selama sintesis senyawa deterjen. Ini secara aktif berkontribusi pada pembentukan surfaktan, meningkatkan sifat pembersihan dan pembusaan.
- Industri farmasi banyak menggunakan asam klorosulfat sebagai komponen aktif dalam penelitian dan manufaktur. Ini secara aktif memasukkan kelompok sulfonamida ke dalam molekul obat, yang memiliki dampak signifikan pada sifat farmakologisnya.
- Reaksi polimerisasi secara aktif menggunakan asam klorosulfat sebagai katalis atau inisiator untuk sintesis polimer khusus. Polimer ini secara aktif menemukan aplikasi di berbagai industri, seperti pelapis, perekat dan isolasi listrik.
- Ini berfungsi sebagai perantara penting dalam produksi berbagai bahan kimia, termasuk asam sulfonat, ester asam sulfat, dan klorosulfonat. Senyawa ini dapat diterapkan di berbagai industri seperti farmasi, agrokimia, dan manufaktur polimer.
- Di laboratorium, peneliti aktif menggunakan asam klorosulfat sebagai reagen berbagai reaksi kimia, seperti reaksi esterifikasi, asilasi, dan dehidrasi.
Penting untuk menangani asam klorosulfat dengan hati-hati karena sifatnya yang korosif dan potensi risiko kesehatan.
Pertanyaan:
T: Bagaimana cara membuat asetamidobenzenasulfonil klorida dari asetanilida dan asam klorosulfonat?
A: Asetamidobenzenasulfonil klorida dibentuk dengan mereaksikan asetanilida dengan asam klorosulfat, menghasilkan substitusi gugus amino dengan gugus sulfonil klorida.
T: Bagaimana cara menggunakan asam klorosulfonat?
A: Asam klorosulfat digunakan sebagai reagen dalam berbagai reaksi kimia, seperti sulfonasi, esterifikasi dan asilasi, untuk memasukkan gugus fungsi atau memodifikasi struktur molekul.
T: Apakah asam klorosulfonat merupakan gugus pergi yang baik?
A: Ya, asam klorosulfat merupakan gugus pergi yang baik karena stabilitas gugus asam sulfonat dan kemampuannya untuk menjalani reaksi substitusi.
T: Bagaimana cara menghilangkan asam klorosulfonat?
J: Asam klorosulfat harus dinetralkan dengan basa, seperti natrium karbonat, kemudian diencerkan dengan air dan dibuang dengan hati-hati sesuai dengan peraturan setempat.
T: Apa yang terjadi jika asam klorosulfonat bersentuhan dengan air?
J: Ketika asam klorosulfat bersentuhan dengan air, ia bereaksi dengan kuat, melepaskan panas dan gas beracun, seperti sulfur dioksida dan hidrogen klorida.
T: Dapatkah natrium lauril sulfat dibuat dengan mengganti asam klorosulfonat dengan reagen lain?
A: Ya, natrium lauril sulfat dapat disintesis dengan mengganti asam klorosulfat dengan asam sulfat dalam reaksi dengan lauril alkohol, diikuti dengan netralisasi dengan natrium hidroksida.
Q: Berapa massa jenis asam klorosulfonat?
A: Massa jenis asam klorosulfat kira-kira 1,75 g/mL pada suhu kamar.
Q: Berapa mol asam klorosulfonat yang diperlukan untuk menghasilkan satu mol asetamidobenzenasulfonil klorida?
A: Satu mol asetamidobenzenasulfonil klorida dapat diperoleh dengan mereaksikan satu mol asetanilida dengan satu mol asam klorosulfat.
T: Dapatkah asam klorosulfonat disimpan bersama oksidan?
J: Tidak, asam klorosulfat harus disimpan terpisah dari zat pengoksidasi, karena dapat bereaksi keras atau meningkatkan risiko kebakaran bila bersentuhan dengan zat pengoksidasi.
