Asam klorat (HClO3) adalah asam kuat dan tidak stabil yang dapat diproduksi dengan mencampurkan klorin dioksida dengan air. Ini digunakan dalam bahan pemutih dan desinfektan, serta dalam produksi bahan peledak.
| Nama IUPAC | Asam klorida |
| Formula molekul | HClO3 |
| nomor CAS | 7790-93-4 |
| Sinonim | Asam perklorat, klorat; larutan asam klorida; Asam klorida (V); Hidrogen klorat; Hidrogen triklorat |
| Di ChI | InChI=1S/ClHO3/c2-1(3)4/jam(H,2,3,4) |
Sifat asam klorat (HClO3) menjadi perhatian khusus bagi ahli kimia dan insinyur karena banyak aplikasi industrinya.
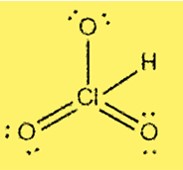
Struktur Lewis HClO3
Struktur Lewis HClO3 menunjukkan bahwa klor merupakan atom pusat yang terikat pada tiga atom oksigen dan satu atom hidrogen. Klorin memiliki 7 elektron valensi dan setiap oksigen memiliki 6 elektron valensi. Strukturnya mencakup tiga ikatan tunggal dan satu ikatan rangkap antara atom klor dan oksigen.
Rumus asam klorida (HClO3).
Rumus kimia asam klorat (HClO3) adalah HClO3. Ini adalah asam anorganik yang mengandung satu atom klor, satu atom hidrogen dan tiga atom oksigen. Rumus asam klorat (HClO3) digunakan untuk menghitung stoikiometri dan konsentrasi larutan yang mengandung asam.
Massa molar asam klorida (HClO3).
Massa molar asam klorat (HClO3) adalah 84,46 g/mol. Ini adalah asam yang relatif ringan dibandingkan dengan asam anorganik lainnya, seperti asam sulfat, yang memiliki massa molar 98,08 g/mol. Massa molar asam klorat (HClO3) merupakan parameter penting dalam menghitung konsentrasi dan stoikiometri larutan yang mengandung asam.
Titik didih asam klorat (HClO3)
Asam klorat (HClO3) memiliki titik didih 40,5°C. Ini adalah asam yang sangat mudah menguap yang dapat terurai pada suhu tinggi, sehingga sulit untuk ditangani dan disimpan. Titik didih rendah asam klorat (HClO3) merupakan pertimbangan penting dalam desain peralatan dan proses yang melibatkan penggunaan asam.
Titik lebur asam klorat (HClO3)
Asam klorat (HClO3) tidak memiliki titik leleh yang jelas. Ia dapat terurai sebelum mencapai titik lelehnya, melepaskan gas oksigen dan meninggalkan residu klorat. Tidak adanya titik leleh yang jelas disebabkan oleh ketidakstabilan asam klorat (HClO3).
Massa jenis asam klorat (HClO3) g/ml
Massa jenis asam klorat (HClO3) adalah 1,97 g/cm³. Ini adalah asam yang relatif padat dibandingkan dengan asam anorganik lainnya, seperti asam klorida, yang memiliki massa jenis 1,18 g/cm³. Kepadatan asam klorat (HClO3) yang tinggi merupakan pertimbangan penting dalam perancangan proses yang melibatkan penanganan dan pengangkutan asam.
Berat molekul asam klorat (HClO3)
Berat molekul asam klorat (HClO3) adalah 84,46 g/mol. Ini adalah jumlah berat atom unsur-unsur penyusunnya: satu atom klor, satu atom hidrogen, dan tiga atom oksigen. Berat molekul asam klorat (HClO3) merupakan parameter penting dalam menghitung konsentrasi dan stoikiometri larutan yang mengandung asam.
Struktur asam klorat (HClO3)
Struktur asam klorat terdiri dari atom klor pusat yang terikat pada tiga atom oksigen dan satu atom hidrogen. Molekul tersebut memiliki geometri tetrahedral, dengan atom klor berada di tengah tetrahedron. Ketiga atom oksigen tersusun mengelilingi atom klor dalam susunan trigonal planar, sedangkan atom hidrogen terikat pada salah satu atom oksigen. Struktur asam klorat (HClO3) penting untuk memahami sifat kimia dan reaktivitasnya.
| Penampilan | Cairan bening atau kekuningan |
| Berat jenis | 1.97 |
| Warna | Tidak berwarna sampai kuning |
| Bau | Tidak berbau |
| Masa molar | 84,46 g/mol |
| Kepadatan | 1,68 gram/cm³ |
| Titik fusi | Terurai sebelum meleleh |
| Titik didih | 40,5°C |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Dapat bercampur |
| Kelarutan | Larut dalam sebagian besar pelarut organik |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| PKa | -0,6 |
| PH | <1 |
Asam Klorat (HClO3) Keamanan dan bahaya
Asam klorat (HClO3) menimbulkan beberapa risiko keamanan dan harus ditangani dengan hati-hati. Ini adalah oksidan kuat yang dapat bereaksi hebat dengan banyak bahan organik, termasuk bahan bakar, zat pereduksi, dan cairan yang mudah terbakar. Bahan ini dapat menyebabkan luka bakar parah pada kulit dan mata jika terkena dan mungkin bersifat korosif pada permukaan logam. Menghirup uapnya dapat menyebabkan iritasi pernafasan dan batuk. Karena sifatnya yang reaktif, obat ini harus disimpan dan ditangani di tempat yang berventilasi baik, jauh dari bahan kimia lainnya. Peralatan pelindung, seperti sarung tangan, kacamata dan respirator, harus dipakai saat menangani asam klorat untuk menghindari paparan. Jika terjadi kontak kulit atau mata, perhatian medis segera harus dicari.
| Simbol bahaya | Agen pengoksidasi |
| Deskripsi Keamanan | Hindari kontak dengan kulit dan mata; memakai peralatan pelindung |
| Sebuah pengidentifikasi | PBB 3084 |
| kode HS | 2811.19 |
| Kelas bahaya | 5.1 |
| Kelompok pengepakan | II |
| Toksisitas | Korosif; dapat menyebabkan luka bakar parah pada kulit dan mata |
Metode sintesis asam klorat (HClO3)
Asam klorida dapat disintesis dengan beberapa metode, antara lain dengan mereaksikan gas klor dengan natrium hidroksida atau natrium klorat. Metode yang umum adalah reaksi natrium klorat dengan asam klorida.
Reaksi sintesis asam klorat melibatkan reaksi natrium klorat (NaClO3) dengan asam klorida (HCl) dalam proses dua langkah. Langkah pertama melibatkan konversi natrium klorat menjadi natrium klorit (NaClO2) dan gas klor dioksida (ClO2) dengan adanya katalis asam. Pada langkah kedua, gas klor dioksida bereaksi dengan asam klorida berlebih membentuk asam klor dan gas klor.
Metode lain untuk mensintesis asam klorat melibatkan elektrolisis larutan yang mengandung natrium klorida, asam nitrat, dan asam sulfat. Proses ini menghasilkan gas klor yang bereaksi dengan air membentuk asam klorat.
Untuk menghasilkan asam klorat, kalium klorat dapat direaksikan dengan asam sulfat dan kemudian campuran yang diperoleh disuling.
Sintesis asam klorat memerlukan penanganan reagen yang hati-hati karena risiko reaksi hebat dan sifat korosif dari asam yang terlibat. Penting untuk mengikuti protokol keselamatan yang tepat dan menangani material di area yang berventilasi baik dengan menggunakan peralatan pelindung yang sesuai.
Kegunaan asam klorat (HClO3)
Asam klorat (HClO3) memiliki beberapa aplikasi di berbagai industri karena sifat pengoksidasinya yang kuat. Beberapa kegunaannya adalah:
- Produksi bahan kimia lainnya: Asam klorat berfungsi sebagai perantara dalam produksi bahan kimia lainnya, termasuk asam perklorat, klorat, dan perklorat.
- Bahan Pemutih: Industri pulp dan kertas menggunakan asam klorat sebagai bahan pemutih.
- Disinfektan: Asam klorat bertindak sebagai disinfektan dalam industri makanan dan minuman untuk mendisinfeksi peralatan dan permukaan.
- Etchant: Industri semikonduktor menggunakan asam klorat sebagai etsa untuk menghilangkan lapisan material yang tidak diinginkan dari wafer semikonduktor.
- Reagen Laboratorium: Asam klorat digunakan sebagai reagen laboratorium dalam kimia analitik dan sintesis organik.
- Zat pengoksidasi: Asam klorat digunakan sebagai zat pengoksidasi dalam reaksi kimia organik.
- Propelan roket: Asam klorat berfungsi sebagai oksidan dalam propelan roket.
- Pengolahan Air: Asam klorat digunakan dalam pengolahan air untuk mengendalikan pertumbuhan alga dan bakteri.
Pertanyaan:
Q: Apakah asam klorat termasuk asam kuat?
A: Ya, asam klorat (HClO3) adalah asam kuat.
Q: Rumus apa yang mewakili asam klorat?
A: Rumus asam klorat adalah HClO3.
Q: Jelaskan mengapa HCl adalah asam klorida dan HClO3 adalah asam klorat?
J: Nama asam biner (senyawa yang hanya mengandung dua unsur) biasanya diambil dari nama anionnya, dengan akhiran -ic untuk anion yang paling umum dan -ous untuk anion yang paling tidak umum. Dalam kasus HCl, anionnya adalah klorida (Cl-), sehingga asamnya disebut asam klorida. Dalam kasus HClO3, anionnya adalah klorat (ClO3-), sehingga asamnya disebut asam klorat.
Q: Apa rumus asam klorat?
A: Rumus asam klorat adalah HClO3.
T: Apakah asam klorat bersifat ionik atau molekuler?
J: Asam klorat bersifat molekuler karena terdiri dari atom hidrogen, klor, dan oksigen yang terikat secara kovalen.
