Asam karbonat (H2CO3) terbentuk ketika karbon dioksida larut dalam air dan memainkan peran penting dalam mengatur pH laut dan mengendalikan pelapukan batuan.
| Nama IUPAC | Asam karbonat |
| Formula molekul | H2CO3 |
| nomor CAS | 463-79-6 |
| Sinonim | Udara asam; Udara asam; H2CO3; Oksidaniumilidenametana; Karbonat asam; hidroksiketon; Dihidroksimetana |
| Di ChI | InChI=1S/CH2O3/c2-1(3)4/jam(H2,2,3,4) |
Rumus asam karbonat
Rumus kimia asam karbonat adalah H2CO3, yang menunjukkan bahwa ia tersusun dari dua atom hidrogen, satu atom karbon, dan tiga atom oksigen. Rumusnya juga menunjukkan perbandingan atom dalam molekul, yang penting untuk menentukan stoikiometri reaksi kimia yang melibatkan asam karbonat.
Massa molar asam karbonat
Massa molar asam karbonat kira-kira 62,03 g/mol. Ini adalah asam lemah yang terbentuk ketika karbon dioksida larut dalam air dan bertanggung jawab untuk mengatur pH lautan. Massa molar asam karbonat penting untuk menghitung jumlah asam yang dibutuhkan untuk mencapai pH tertentu dalam suatu larutan dan untuk menentukan berapa banyak karbon dioksida yang dapat larut dalam air.
Titik didih asam karbonat
Asam karbonat tidak mempunyai titik didih yang jelas, karena ia terurai menjadi air dan karbon dioksida sebelum mencapai titik didihnya. Namun, pada tekanan atmosfer, asam karbonat terurai pada suhu sekitar 333 K (60 °C) menjadi air dan karbon dioksida.
Titik leleh asam karbonat
Asam karbonat juga tidak memiliki titik leleh yang jelas, karena ia terurai menjadi air dan karbon dioksida sebelum mencapai titik lelehnya. Namun, pada tekanan atmosfer, asam karbonat terurai pada suhu sekitar 273 K (-0,15 °C) menjadi air dan karbon dioksida.
Massa jenis asam karbonat g/ml
Massa jenis asam karbonat kira-kira 1,67 g/mL pada suhu kamar (25°C). Nilai ini dapat bervariasi tergantung pada konsentrasi larutan, serta suhu dan tekanan lingkungan.
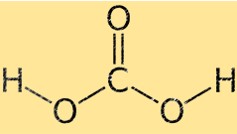
Struktur asam karbonat
Asam karbonat memiliki geometri molekul tetrahedral, dengan atom karbon di tengah dan empat atom di sekitarnya (dua oksigen dan dua hidrogen) terletak di sudut tetrahedron. Kedua atom oksigen terikat pada atom karbon melalui ikatan rangkap, sedangkan dua atom hidrogen dihubungkan melalui ikatan tunggal.
Berat molekul asam karbonat
Berat molekul asam karbonat adalah 62,03 g/mol. Nilai ini dihitung dengan menjumlahkan berat atom unsur-unsur penyusunnya, yaitu hidrogen (H), karbon (C), dan oksigen (O).
| Penampilan | Cairan tidak berwarna atau padatan kristal |
| Berat jenis | 1,67 gram/cm³ |
| Warna | Tanpa warna |
| Bau | Tidak berbau |
| Masa molar | 62,03 g/mol |
| Kepadatan | 1,67 g/mL pada suhu kamar (25°C) |
| Titik fusi | Terurai pada suhu sekitar 273 K (-0,15 °C) |
| Titik didih | Terurai pada suhu sekitar 333 K (60°C) |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Benar-benar larut |
| Kelarutan | Larut dalam air, etanol, metanol |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | 3.6 (disosiasi pertama) |
| pH | 5.6 (dalam larutan 0,1M) |
Keamanan dan bahaya asam karbonat
Asam karbonat (H2CO3) umumnya dianggap aman, namun dapat menimbulkan beberapa bahaya dalam situasi tertentu. Paparan H2CO3 dapat menyebabkan iritasi pada mata, kulit, dan sistem pernapasan serta menyebabkan batuk, mengi, dan sesak napas. Menelan H2CO3 dapat menyebabkan sakit perut, mual dan muntah. H2CO3 juga merupakan asam lemah dan dapat bereaksi dengan logam tertentu, seperti aluminium dan seng, menghasilkan gas hidrogen yang mudah terbakar. Saat menangani atau menggunakan H2CO3, tindakan pencegahan keselamatan yang tepat harus dilakukan, termasuk mengenakan pakaian pelindung dan ventilasi yang memadai. Jika terpapar, pertolongan medis harus segera dicari.
| Simbol bahaya | Tidak ada |
| Deskripsi Keamanan | Tidak beracun |
| Nomor identifikasi PBB | Sebuah tahun 1824 |
| kode HS | 28111990 |
| Kelas bahaya | 8 – Zat korosif |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | Toksisitas rendah |
Metode sintesis asam karbonat
H2CO3 dapat disintesis dengan metode yang berbeda. Metode yang umum adalah mereaksikan karbon dioksida (CO2) dengan air (H2O) dengan adanya katalis. Proses ini, yang disebut hidrasi, menghasilkan asam karbonat:
CO2 + H2O → H2CO3
Metode lain untuk mensintesis asam karbonat melibatkan mereaksikan kalsium karbonat (CaCO3) dengan asam, seperti asam klorida (HCl). Proses ini, yang disebut pengasaman, menghasilkan asam karbonat:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Reaksi antara asam oksalat dan karbonat, seperti natrium karbonat (Na2CO3), memungkinkan asam karbonat disintesis. Proses ini menghasilkan asam karbonat dan garam, seperti natrium oksalat:
H2C2O4 + Na2CO3 → 2H2CO3 + Na2C2O4
Proses Solvay menghasilkan asam karbonat dan natrium bikarbonat melalui reaksi natrium karbonat (Na2CO3) dengan karbon dioksida dengan adanya air.
2NaHCO3 + CO2 → Na2CO3 + H2CO3
Secara keseluruhan, ada beberapa metode yang tersedia untuk sintesis asam karbonat, masing-masing memiliki kelebihan dan keterbatasannya sendiri. Pilihan metode akan bergantung pada faktor-faktor seperti kemurnian produk yang diinginkan, ketersediaan bahan mentah, dan skala produksi yang diperlukan.
Kegunaan asam karbonat
Asam karbonat (H2CO3) adalah senyawa serbaguna yang banyak digunakan dalam industri, kedokteran, dan kehidupan sehari-hari. Beberapa kegunaan utama H2CO3 meliputi:
- Minuman berkarbonasi: H2CO3 adalah senyawa yang bertanggung jawab atas karakteristik desis pada minuman berkarbonasi seperti soda dan bir.
- H2CO3 menyangga pH dalam berbagai proses industri, seperti pengolahan air dan pengolahan makanan.
- Ini menekan api dengan menggantikan oksigen dan mencegah pembakaran.
- H2CO3 menghambat pertumbuhan bakteri dan jamur pada jenis produk makanan tertentu untuk mengawetkannya.
- Ia bertindak sebagai bahan pembersih yang lembut, terutama untuk menghilangkan endapan mineral.
- Profesional kesehatan menggunakan H2CO3 dalam aplikasi tertentu, termasuk untuk mengobati lesi kulit tertentu dan menyebabkan penyempitan bronkus selama tes fungsi paru-paru.
- Tukang las menggunakan H2CO3 sebagai gas pelindung untuk mencegah oksidasi dan menghasilkan hasil las yang lebih bersih.
Secara keseluruhan, asam karbonat merupakan senyawa berguna dan serbaguna yang memiliki beragam aplikasi di berbagai bidang.
Pertanyaan:
Q: Apakah asam karbonat termasuk asam kuat?
J: Asam karbonat merupakan asam lemah, artinya asam ini hanya terdisosiasi sebagian dalam air menghasilkan ion hidrogen (H+) dan ion bikarbonat (HCO3-). Konstanta disosiasi asamnya (Ka) relatif rendah, menunjukkan bahwa ia tidak terdisosiasi sempurna dalam air.
T: Apakah karbon dioksida bersifat asam?
J: Karbon dioksida (CO2) pada dasarnya tidak bersifat asam, karena merupakan senyawa netral yang tidak menghasilkan ion hidrogen (H+) dalam air. Namun ketika CO2 dilarutkan dalam air, ia dapat bereaksi dengan molekul air membentuk asam karbonat yang merupakan asam lemah. Reaksi ini dapat menyebabkan pH menurun sehingga membuat larutan menjadi lebih asam. Oleh karena itu, meskipun CO2 sendiri tidak bersifat asam, namun dapat menyebabkan keasaman suatu larutan ketika bereaksi dengan air.
