Asam hidrazoat (HN3) merupakan senyawa yang sangat mudah menguap. Tidak berwarna dan berbau menyengat. Ini digunakan dalam reaksi kimia dan dapat menjadi racun dan ledakan.
| Nama IUPAC | Asam hidrazoat |
| Formula molekul | HN3 |
| nomor CAS | 7782-79-8 |
| Sinonim | Azoimida, hidrogen azida, asam azotik, asam hidronitrat, asam triazoat |
| Di ChI | InChI=1S/HN3/c1-3-2/h1H |
Sifat asam hidrazoat
Rumus Asam Hidrazoat
Rumus kimia asam hidrazoat adalah HN3. Ini terdiri dari satu atom hidrogen dan tiga atom nitrogen yang terikat bersama secara kovalen. Rumus sederhana ini mewakili komposisi dasar senyawa, yang penting untuk memahami sifat dan reaksinya.
Massa Molar Asam Hidrazoat
Massa molar hidrogen azida (HN3) kira-kira 43,03 gram per mol. Nilai ini diperoleh dengan menjumlahkan massa atom satu atom hidrogen (H) dan tiga atom nitrogen (N). Massa molar sangat penting untuk menghitung stoikiometri dalam reaksi kimia.
Titik didih asam hidrazoat
Hidrogen azida memiliki titik didih yang relatif rendah, sekitar 37 derajat Celcius (98,6 derajat Fahrenheit). Karena sifatnya yang mudah menguap, ia mudah menguap menjadi bentuk gas pada suhu sedang. Diperlukan kehati-hatian yang ekstrim saat menangani senyawa ini.
Titik lebur asam hidrazoat
Titik leleh hidrogen azida adalah sekitar -80 derajat Celsius (-112 derajat Fahrenheit). Pada suhu ini, senyawa padat berubah wujud menjadi cair. Karena sangat reaktif, bentuk padatnya memerlukan penyimpanan dan penanganan yang tepat.
Massa jenis asam hidrazoat g/mL
Massa jenis hidrogen azida kira-kira 1,09 gram per mililiter. Nilai ini menunjukkan massa per satuan volume, yang mencerminkan kekompakan dan konsentrasinya dalam ruang tertentu. Ini adalah parameter penting untuk pengukuran laboratorium.
Berat Molekul Asam Hidrazoat
Berat molekul hidrogen azida (HN3) adalah 43,03 gram per mol. Ini adalah jumlah berat atom unsur-unsur yang ada dalam satu molekul senyawa. Berat molekul memainkan peran penting dalam menentukan perilaku fisik dan kimianya.
Struktur asam hidrazoat
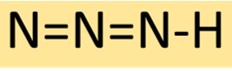
Hidrogen azida memiliki struktur molekul linier, terdiri dari tiga atom nitrogen yang terikat secara berurutan dengan satu atom hidrogen di ujungnya. Susunan ini menghasilkan senyawa yang stabil namun sangat reaktif, sering digunakan dalam sintesis kimia.
Kelarutan asam hidrazoat
Hidrogen azida memiliki kelarutan yang terbatas dalam air, menjadikannya senyawa yang sukar larut. Ia dapat larut sedikit dalam larutan air, namun kelarutannya yang rendah membatasi penggunaannya dalam beberapa aplikasi. Perhatian khusus diperlukan ketika menangani bentuk airnya karena sifatnya yang beracun dan mudah meledak.
| Penampilan | Cairan tidak berwarna |
| Berat jenis | 1,09g/ml |
| Warna | Tanpa warna |
| Bau | Bau yang menyengat |
| Masa molar | 43,03 g/mol |
| Kepadatan | 1,09g/ml |
| Titik fusi | -80°C (-112°F) |
| Titik didih | 37°C (98,6°F) |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sedikit larut |
| Kelarutan | Larut dalam pelarut basa dan organik seperti alkohol, eter |
| Tekanan uap | 23,1 mmHg pada 20°C |
| Kepadatan uap | 1.4 (udara = 1) |
| pKa | 4.6 |
| pH | Sekitar 3-4 |
Keamanan dan Bahaya Asam Hidrazoat
Hidrogen azida menimbulkan risiko keamanan yang signifikan. Ini sangat beracun dan dapat menyebabkan efek kesehatan yang serius jika terpapar. Menghirup uap atau kabutnya dapat menyebabkan iritasi pernafasan, pusing dan bahkan kematian. Kontak dengan kulit atau mata dapat menyebabkan luka bakar, iritasi dan kerusakan jaringan. Senyawa ini juga sangat mudah terbakar dan dapat membentuk campuran yang mudah meledak. Ia bereaksi hebat dengan berbagai zat, seperti logam dan zat pengoksidasi. Tindakan keselamatan yang tepat harus diikuti saat menangani hidrogen azida, termasuk mengenakan pakaian pelindung, menggunakan ventilasi yang memadai, dan menyimpannya dengan aman untuk menghindari kecelakaan atau pelepasan ke lingkungan. lingkungan.
| Simbol bahaya | Tengkorak dan Tulang Bersilang, Korosif |
| Deskripsi Keamanan | Sangat beracun, korosif |
| Nomor identifikasi PBB | UN1687 |
| kode HS | 2811.29.10 |
| Kelas bahaya | 6.1 (Zat beracun) |
| Kelompok pengepakan | II (Bahaya sedang) |
| Toksisitas | Sangat beracun; bisa berakibat fatal dalam jumlah kecil |
Metode sintesis asam hidrazoat
Berbagai metode memungkinkan sintesis hidrogen azida.
Pendekatan yang umum melibatkan reaksi antara natrium azida (NaN3) dan asam, seperti asam sulfat (H2SO4) atau asam klorida (HCl) . Dalam metode ini, asam bercampur dengan natrium azida, menghasilkan pembentukan hidrogen azida dan garam asam yang digunakan.
Metode lain melibatkan reaksi antara natrium azida dan alkil halida, seperti metil iodida (CH3I) atau etil iodida (C2H5I). Reaksi ini, yang dikenal sebagai penataan ulang Curtius, menghasilkan pembentukan hidrogen azida sebagai produk.
Reaksi antara natrium azida dan asam nitrat (HNO2) menghasilkan hidrogen azida. Untuk menghasilkan asam nitrat in situ, natrium nitrit (NaNO2) biasanya ditambahkan ke larutan asam. Reaksi antara natrium azida dan asam nitrat menghasilkan hidrogen azida.
Penting untuk dicatat bahwa sintesis hidrogen azida memerlukan penanganan yang hati-hati dan tindakan keselamatan yang tepat. Karena sifat toksisitas dan ledakannya, reaksi harus dilakukan di area yang berventilasi baik, menggunakan peralatan pelindung yang sesuai, dan mengikuti protokol yang ditetapkan.
Setiap metode sintesis memiliki kelebihan dan keterbatasannya, dan pilihan metode bergantung pada faktor-faktor seperti ketersediaan reagen, hasil yang diinginkan, dan pertimbangan keamanan. Pemahaman dan keahlian yang baik dalam menangani bahan kimia berbahaya sangat penting untuk melakukan sintesis secara efisien dan aman.
Kegunaan Asam Hidrazoat
Hidrogen azida menemukan aplikasi di berbagai bidang karena sifatnya yang unik. Berikut beberapa kegunaannya:
- Reagen Kimia: Hidrogen azida berfungsi sebagai reagen kimia serbaguna dalam sintesis organik, secara aktif berpartisipasi dalam banyak reaksi, termasuk sintesis azida, yang merupakan bahan penyusun penting dalam obat-obatan dan pewarna.
- Detonator dan propelan: Produsen menggunakan hidrogen azida untuk produksi detonator dan propelan yang digunakan dalam kantung udara dan perangkat keselamatan, karena sifatnya yang mudah meledak dan dekomposisi yang cepat, yang secara aktif melepaskan gas nitrogen, sehingga menjadikannya berharga dalam aplikasi ini.
- Analisis Laboratorium: Kimia analitik menggunakan hidrogen azida untuk deteksi aktif dan penentuan berbagai unsur dan senyawa. Ia secara aktif membentuk kompleks dengan logam tertentu, memungkinkan kuantifikasinya dengan metode kolorimetri atau titrasi.
- Penelitian Biokimia: Dalam penelitian biokimia, para ilmuwan secara aktif menggunakan hidrogen azida untuk memodifikasi biomolekul dan mempelajari fungsinya. Ia bereaksi secara selektif dengan gugus fungsi tertentu, sehingga secara aktif berkontribusi pada identifikasi dan karakterisasi molekul biologis.
- Fotografi: Dalam fotografi hitam putih tradisional, hidrogen azida secara aktif berfungsi sebagai pemeka dalam emulsi, meningkatkan sensitivitas cahaya film fotografi dan secara aktif menghasilkan kualitas gambar yang lebih baik.
- Inhibitor Korosi: Industri secara aktif menggunakan hidrogen azida sebagai inhibitor korosi pada logam, terutama tembaga dan paduannya. Ini secara aktif membentuk lapisan pelindung pada permukaan logam, secara aktif mencegah korosi dan memperpanjang masa pakai berbagai peralatan dan struktur.
- Generator gas: Hidrogen azida secara aktif berperan dalam generator gas untuk kantung udara dan sistem penyelamatan. Dekomposisinya yang cepat secara aktif melepaskan gas nitrogen, memberikan kekuatan yang diperlukan untuk inflasi dan penyebaran.
Pertanyaan:
T: Apakah asam hidrazoat bersifat kaustik?
J: Ya, asam hidrazoat dianggap bersifat kaustik dan dapat menyebabkan luka bakar dan kerusakan jaringan jika bersentuhan.
Q: Apakah asam hidrazoat termasuk asam kuat?
A: Ya, asam hidrazoat tergolong asam kuat, mampu terionisasi sempurna dalam air untuk melepaskan ion hidronium.
T: Apakah asam hidrazoat termasuk asam terner?
J: Tidak, asam hidrazoat bukanlah asam terner. Asam terner mengandung tiga unsur berbeda (hidrogen, oksigen, dan unsur ketiga), sedangkan asam hidrazoat hanya mengandung hidrogen, nitrogen, dan oksigen.
T: Berapa ml asam hidrazoat per 12,5ml?
J: Pertanyaannya sepertinya tidak lengkap dan memerlukan informasi tambahan untuk mendapatkan jawaban yang akurat.
Q: Bagaimana struktur Lewis yang benar untuk asam hidrazoat (HN3), termasuk muatan formalnya, jika ada?
J: Struktur Lewis yang benar untuk HN3 terdiri dari atom nitrogen pusat yang terikat pada tiga atom nitrogen lainnya dan satu atom hidrogen. Muatan formal dapat ditentukan berdasarkan perbedaan keelektronegatifan.
T: Bagaimana asam hidrazoat mempengaruhi sitokrom c oksidase?
J: Hidrogen azida menghambat sitokrom c oksidase, suatu enzim yang terlibat dalam respirasi sel, dengan mengikat situs aktifnya dan mengganggu fungsinya.
Q: Berapakah Ka asam hidrazoat jika asam hidrazoat 0,20 M mempunyai pH 3,21?
A: Ka asam hidrazoat dapat dihitung menggunakan pH dan persamaan Ka = [H3O+][A-]/[HA]. Informasi lebih lanjut diperlukan untuk menentukan nilai Ka.
Q: Berapakah bilangan oksidasi nitrogen dalam asam hidrazoat (HN3)?
A: Bilangan oksidasi nitrogen dalam asam hidrazoat adalah -1.
Q: Berapa pH larutan HN3 0,15 molar jika Ka = 1,8 × 10^-9?
A: PH larutan HN3 0,15 molar dapat dihitung menggunakan nilai Ka dan persamaan pH = -log10(sqrt(Ka × [HA])).
Q: Bagaimana cara menyeimbangkan N2 + H2 menjadi HN3?
A: Persamaan reaksi setara N2 + H2 → HN3 adalah 3N2 + 6H2 → 2HN3.
Q: Bagaimana cara menghitung Ka HN3?
A: Ka HN3 dapat dihitung menggunakan konsentrasi kesetimbangan produk dan reaktan dalam reaksi disosiasi HN3.
Q: Berapa molaritas NaN3 jika molaritas HN3 0,012 M?
A: Molaritas NaN3 tidak dapat ditentukan tanpa informasi tambahan atau persamaan reaksi antara NaN3 dan HN3.
Q: Bagaimana struktur Lewis yang benar untuk asam hidrazoat (HN3), termasuk muatan formalnya, jika ada?
J: Struktur Lewis yang benar untuk HN3 mencakup atom nitrogen pusat yang terikat pada tiga atom nitrogen lainnya dan satu atom hidrogen. Muatan formal dapat ditentukan berdasarkan perbedaan keelektronegatifan.
