Asam fosfat (H3PO4) merupakan asam mineral yang tidak berwarna dan tidak berbau. Ini banyak digunakan dalam industri makanan dan minuman sebagai bahan penyedap dan sebagai penghambat karat pada industri otomotif.
| Nama IUPAC | Asam fosfat |
| Formula molekul | H3PO4 |
| nomor CAS | 7664-38-2 |
| Sinonim | Asam ortofosfat, trihidroksidooksidofosfat, asam fosfat (V), asam ortofosfat, teknologi asam fosfat bening, fosforsaeur |
| Di ChI | InChI=1S/H3O4P/c1-5(2,3)4/jam(H3,1,2,3,4) |
Sifat asam fosfat
Massa molar asam fosfat
Massa molar asam fosfat adalah 98,00 g/mol. Nilai ini dihitung dengan menjumlahkan massa atom masing-masing atom penyusun molekul, yaitu satu atom fosfor dan tiga atom oksigen. Massa molar merupakan sifat penting suatu senyawa karena digunakan untuk menghitung jumlah zat yang ada dalam sampel tertentu menggunakan bilangan Avogadro. Selain itu, massa molar asam fosfat digunakan untuk menentukan konsentrasi larutan dengan titrasi.
Formula Asam Fosfat
Rumus kimia asam fosfat adalah H3PO4 yang menunjukkan bahwa ia mengandung satu atom fosfor, tiga atom hidrogen, dan empat atom oksigen. Ini adalah asam lemah yang dapat menyumbangkan hingga tiga ion hidrogen ke basa. Rumusnya penting karena memungkinkan kita menulis persamaan kimia dan menghitung stoikiometri reaksi kimia yang melibatkan asam fosfat. Selain itu, rumus tersebut digunakan untuk menghitung konsentrasi larutan asam fosfat dengan titrasi.
Titik didih asam fosfat
Titik didih asam fosfat adalah 158°C (316°F) pada tekanan 1 atmosfer. Artinya pada suhu dan tekanan tersebut, fasa cair asam fosfat akan berubah menjadi fasa gas. Titik didih bergantung pada gaya antarmolekul yang ada dalam senyawa dan, dalam kasus asam fosfat, hal ini disebabkan oleh adanya ikatan hidrogen antar molekul. Titik didih merupakan sifat fisik penting suatu senyawa karena digunakan untuk menentukan volatilitasnya, yang berguna dalam banyak proses industri.
Titik leleh asam fosfat
Titik leleh asam fosfat adalah 42,35°C (108,23°F). Ini adalah suhu di mana fase padat asam fosfat akan berubah menjadi fase cair. Titik leleh bergantung pada kekuatan gaya antarmolekul yang ada dalam senyawa dan, dalam kasus asam fosfat, hal ini disebabkan oleh adanya ikatan hidrogen antar molekul. Titik leleh merupakan sifat fisik penting suatu senyawa karena digunakan untuk menentukan kemurnian dan menentukan identitasnya.
Massa jenis asam fosfat g/ml
Massa jenis asam fosfat adalah 1,685 g/ml pada suhu kamar (25°C atau 77°F). Ini adalah massa zat per satuan volume. Massa jenis adalah sifat fisik suatu zat dan digunakan untuk menghitung volume suatu massa suatu zat atau massa suatu volume zat tertentu. Kepadatan asam fosfat penting dalam banyak proses industri, termasuk produksi pupuk, deterjen, dan bahan tambahan makanan.
Berat Molekuler Asam Fosfat
Berat molekul asam fosfat adalah 98,00 g/mol. Ini adalah jumlah berat atom semua atom dalam molekul. Berat molekul merupakan sifat penting suatu senyawa karena digunakan untuk menghitung jumlah zat yang ada dalam sampel tertentu. Selain itu, berat molekul asam fosfat digunakan untuk menentukan konsentrasi larutan dengan titrasi.
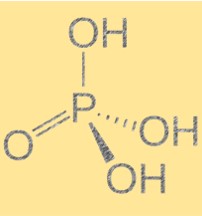
Struktur asam fosfat (H3PO4)
Asam fosfat memiliki rumus molekul H3PO4 dan geometri molekul tetrahedral. Ini adalah asam triprotik, artinya dapat menyumbangkan tiga ion hidrogen ke satu basa. Molekul tersebut mengandung atom fosfor yang terikat pada empat atom oksigen, tiga di antaranya terikat pada atom hidrogen. Struktur asam fosfat penting karena menentukan sifat kimia dan fisiknya. Adanya ikatan hidrogen antar molekul menimbulkan titik didih dan titik leleh yang tinggi.
| Penampilan | Cairan tidak berwarna |
| Berat jenis | 1,685 pada 25°C |
| Warna | Tanpa warna |
| Bau | Tidak berbau |
| Masa molar | 98,00 g/mol |
| Kepadatan | 1,685 g/ml pada 25°C |
| Titik fusi | 42,35°C (108,23°F) |
| Titik didih | 158°C (316°F) pada tekanan 1 atm |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Benar-benar larut dalam air |
| Kelarutan | Larut dalam etanol, dietil eter dan aseton |
| Tekanan uap | 0,0002 mmHg pada 20°C |
| Kepadatan uap | 3,5 (udara = 1) |
| pKa | pKa1=2,148, pKa2=7,198, pKa3=12,319 |
| pH | 1,0 – 2,5 (larutan pekat), 2,8 – 3,2 (larutan encer) |
H3PO4 Keamanan dan bahaya
Asam fosfat menimbulkan beberapa risiko keselamatan dan harus ditangani dengan hati-hati. Ini dapat menyebabkan iritasi parah pada kulit dan mata dan sangat korosif terhadap logam. Kontak langsung dengan kulit, mata, atau selaput lendir dapat menyebabkan luka bakar parah atau bahkan kerusakan permanen. Menghirup asap dapat menyebabkan iritasi saluran pernapasan dan luka bakar. Ini tidak boleh tertelan karena dapat menyebabkan luka bakar internal yang parah dan gangguan pencernaan. Saat menangani asam fosfat, peralatan pelindung diri yang sesuai seperti sarung tangan, kacamata dan respirator harus dipakai. Itu juga harus disimpan di tempat sejuk dan kering, jauh dari bahan yang tidak kompatibel seperti zat pengoksidasi dan alkali.
| Simbol bahaya | Korosif |
| Deskripsi Keamanan | Jaga agar wadah tetap tertutup rapat. Kenakan sarung tangan pelindung/pakaian pelindung/pelindung mata/pelindung wajah. |
| Nomor identifikasi PBB | UN1805 |
| kode HS | 280920 |
| Kelas bahaya | 8 (Zat korosif) |
| Kelompok pengepakan | II (bahaya sedang) |
| Toksisitas | LD50 oral (tikus) – 1533 mg/kg |
Metode sintesis H3PO4
Ada beberapa metode untuk mensintesis asam fosfat (H3PO4).
Metode yang paling umum adalah proses basah yang melibatkan reaksi batuan fosfat dengan asam sulfat . Untuk menghasilkan kalsium sulfat (gipsum) dan H3PO4, batuan fosfat terlebih dahulu dihancurkan lalu dicampur dengan asam sulfat pekat. Setelah menyaring suspensi yang dihasilkan, serangkaian langkah ekstraksi pelarut dan pengendapan memurnikan H3PO4.
Metode lain untuk mensintesis H3PO4 adalah proses termal yang melibatkan pemanasan batuan fosfat hingga suhu tinggi untuk menghasilkan H3PO4 dan produk sampingan lainnya seperti unsur fosfor dan kalsium oksida. Metode ini kurang umum dibandingkan proses basah karena kebutuhan energinya yang tinggi.
Reaksi fosfor pentoksida dengan air menghasilkan H3PO4. Industri elektronik dan semikonduktor umumnya menggunakan metode ini untuk menghasilkan H3PO4 dengan kemurnian tinggi.
Metode lain untuk mensintesis H3PO4 meliputi oksidasi elektrokimia fosfor, hidrolisis fosfor triklorida, dan reaksi fosfor dengan asam nitrat . Metode ini kurang umum dibandingkan proses basah dan termal karena biayanya yang tinggi dan kompleksitasnya.
Kegunaan H3PO4
Asam fosfat merupakan senyawa serbaguna yang memiliki berbagai aplikasi di berbagai industri. Beberapa kegunaan utamanya adalah:
- Produksi pupuk: komponen utama produksi pupuk seperti diammonium fosfat dan tripel superfosfat.
- Industri makanan dan minuman: digunakan sebagai bahan tambahan dan penyedap makanan pada berbagai produk makanan dan minuman seperti minuman cola, selai dan keju olahan.
- Pembersih Industri: Digunakan sebagai pembersih dan penghilang karat di sektor industri karena kemampuannya dalam melarutkan karat dan endapan mineral lainnya.
- Pengolahan Air: Digunakan untuk mengontrol tingkat pH air dalam proses industri dan juga untuk menghilangkan logam berat dan kotoran lainnya.
- Farmasi: Digunakan dalam produksi obat-obatan dan suplemen makanan karena kemampuannya mengatur tingkat pH.
- Kedokteran Gigi: Digunakan dalam prosedur gigi seperti perawatan saluran akar dan sebagai komponen semen gigi.
- Perawatan Logam: Digunakan untuk mengolah dan mempasifkan logam seperti baja tahan karat, aluminium, dan titanium untuk meningkatkan ketahanan terhadap korosi.
- Elektronik: Digunakan dalam industri elektronik sebagai bahan pembersih dan sebagai komponen dalam produksi semikonduktor.
Pertanyaan:
Q: Apa rumus asam fosfat?
A: Rumus asam fosfat adalah H3PO4.
Q: Apakah H3PO4 termasuk asam kuat?
J: Tidak, H3PO4 tidak termasuk asam kuat. Ini adalah asam lemah dengan nilai pKa 2,15.
Q: Apakah H3PO4 termasuk asam atau basa?
A: H3PO4 termasuk asam karena ia menyumbangkan proton (H+) jika dilarutkan dalam air.
Q: Apa struktur Lewis untuk H3PO4?
J: Struktur Lewis untuk H3PO4 adalah struktur tetrahedral dengan atom fosfor pusat yang dikelilingi oleh empat atom oksigen. Setiap atom oksigen membentuk ikatan tunggal dengan atom fosfor, dan terdapat juga tiga pasang elektron bebas pada setiap atom oksigen.
Q: Apakah asam fosfat termasuk asam kuat? J: Tidak, asam fosfat tidak dianggap sebagai asam kuat. Ini adalah asam lemah dengan nilai pKa 2,15 untuk sumbangan proton pertama dan 7,20 untuk sumbangan proton kedua.
