Amonium persulfat ((NH4)2S2O8) berbentuk bubuk putih. Ini larut dalam air dan melepaskan oksigen. Ini dapat memutihkan, mengetsa atau memulai polimerisasi.
| Nama IUPAC | Amonium peroksidisulfat |
| Formula molekul | (NH4)2S2O8 |
| nomor CAS | 7727-54-0 |
| Sinonim | Amonium persulfat, Amonium peroksodisulfat, Diammonium persulfat, Diammonium peroksidisulfat |
| Di ChI | InChI=1S/2H3N.H2O8S2/c;;1-9(2,3)7-8-10(4,5)6/h2*1H3;(H,1,2,3)(H,4,5 ,6) |
Sifat amonium persulfat
Formula Amonium Persulfat
Rumus amonium persulfat adalah (NH4)2S2O8. Terdiri dari dua kation amonium (NH4+) dan satu anion persulfat (S2O82-). Anion persulfat memiliki dua gugus sulfat (SO42-) yang dihubungkan oleh ikatan peroksida (OO).
Massa Molar Amonium Persulfat
Massa molar (NH4)2S2O8 adalah 228,18 g/mol. Ini dihitung dengan menjumlahkan massa atom semua atom dalam rumus: 2 x 14,01 (N) + 8 x 1,01 (H) + 2 x 32,06 (S) + 8 x 16,00 (O).
Titik didih amonium persulfat
(NH4)2S2O8 tidak memiliki titik didih karena terurai sebelum mencapai suhu tersebut. Ia terurai pada suhu sekitar 120°C (248°F) menjadi amonia, nitrogen, oksigen, dan air. Reaksi penguraiannya adalah:
(NH4)2S2O8 -> 2NH3 + N2 + O2 + 2H2O
Titik Leleh Amonium Persulfat
(NH4)2S2O8 tidak memiliki titik leleh karena terurai sebelum mencapai suhu tersebut. Ia terurai pada suhu sekitar 120°C (248°F) menjadi amonia, nitrogen, oksigen, dan air. Reaksi penguraiannya adalah:
(NH4)2S2O8 -> 2NH3 + N2 + O2 + 2H2O
Massa jenis amonium persulfat g/mL
Massa jenis (NH4)2S2O8 adalah 1,98 g/mL pada 25°C. Artinya satu mililiter (NH4)2S2O8 beratnya 1,98 gram.
Berat Molekul Amonium Persulfat
Berat molekul (NH4)2S2O8 sama dengan massa molarnya, yaitu 228,18 g/mol. Artinya satu mol (NH4)2S2O8 beratnya 228,18 gram.
Struktur amonium persulfat
Struktur (NH4)2S2O8 dapat direpresentasikan dengan struktur Lewis berikut:
OO
|| ||
O=S||-OOS||=O
|| ||
OO
/\
NH NH
\/
H
/\
NH NH
\/
H
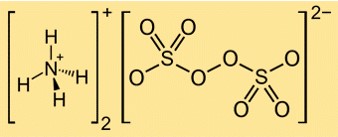
Dalam struktur ini, setiap atom belerang terikat pada empat atom oksigen dalam geometri tetrahedral, dan setiap atom oksigen memiliki dua pasang elektron bebas. Ikatan peroksida antara dua gugus sulfat merupakan ikatan tunggal dengan sepasang elektron. Kation amonium terbentuk dari atom nitrogen yang berbagi tiga elektron dengan masing-masing tiga atom hidrogen dan bermuatan positif.
Kelarutan amonium persulfat
(NH4)2S2O8 sangat larut dalam air, jauh lebih larut dibandingkan garam kalium terkait 1 . Ia larut dalam air untuk membentuk ion amonium dan ion persulfat, yang selanjutnya dapat terdisosiasi menjadi radikal sulfat:
(NH4)2S2O8 -> 2NH4+ + S2O82-
S2O82- -> 2 SO4•-
Kelarutan (NH4)2S2O8 dalam air meningkat seiring dengan meningkatnya suhu. Pada suhu 25°C dapat melarutkan hingga 80g/100ml air. Ini juga cukup larut dalam metanol.
| Penampilan | Kristal berwarna putih hingga kekuningan |
| Kepadatan spesifik | 1,98 |
| Warna | Putih hingga kekuningan |
| Bau | Manis dan tidak menyenangkan |
| Masa molar | 228,18 g/mol |
| Kepadatan | 1,98 g/mL pada 25°C |
| Titik fusi | 120°C (terurai) |
| Titik didih | T/A (terurai) |
| Titik kilat | T/A |
| Kelarutan dalam air | 80 g/100 mL pada suhu 25°C |
| Kelarutan | Cukup larut dalam MeOH |
| Tekanan uap | T/A |
| Kepadatan uap | T/A |
| pKa | T/A |
| pH | T/A |
Keamanan dan bahaya amonium persulfat
(NH4)2S2O8 merupakan oksidator kuat yang dapat mengintensifkan api dan bereaksi secara eksplosif dengan bahan yang mudah terbakar. Hal ini juga dapat menyebabkan berbagai efek kesehatan jika tertelan, terhirup, atau terkena kulit atau mata. Ini dapat mengiritasi kulit, mata, hidung, tenggorokan dan paru-paru. Ini juga dapat menyebabkan reaksi alergi seperti ruam, asma, atau kesulitan bernapas. Ini berbahaya bagi kehidupan akuatik. Oleh karena itu, hal ini harus ditangani dengan hati-hati dan dengan peralatan pelindung yang sesuai. Itu harus disimpan jauh dari panas, percikan api, nyala api dan zat lain yang tidak kompatibel.
| Simbol bahaya | O (oksidan), Xn (berbahaya), Xi (iritan) |
| Deskripsi Keamanan | S17 (Jauhkan dari bahan yang mudah terbakar), S26 (Jika kena mata, segera bilas dengan banyak air dan konsultasikan dengan dokter), S36/37/39 (Pakai pakaian pelindung, sarung tangan, dan pelindung mata/wajah yang sesuai), S45 (Jika terjadi kecelakaan atau jika Anda merasa tidak enak badan, segera dapatkan bantuan medis) |
| Nomor identifikasi PBB | PBB 1444 |
| kode HS | 28334000 |
| Kelas bahaya | 5.1 (Bahan pengoksidasi) |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | Tikus LD50 oral: 689 mg/kg, tikus inhalasi LC50: 2,95 mg/L/4 jam, tikus LD50 kulit: 2000 mg/kg |
Metode sintesis amonium persulfat
Berbagai metode dapat digunakan untuk membuat (NH4)2S2O8 yang merupakan garam anorganik.
Salah satu metode yang paling umum melibatkan elektrolisis larutan amonium sulfat ((NH4)2SO4) dan asam sulfat (H2SO4) yang dingin dan pekat.
Metode ini pertama kali dijelaskan oleh Hugh Marshall. Elektrolisis melibatkan melewatkan arus listrik melalui larutan menggunakan anoda platinum dan katoda perak berpori.
Di anoda, elektrolisis asam sulfat menghasilkan ion hidrogen sulfat HSO4-, yang bergabung dengan air menghasilkan ion persulfat S2O82- dan gas hidrogen H2. Di katoda, gas oksigen O2 mengalami reduksi menghasilkan hidrogen peroksida H2O2, yang bereaksi dengan ion amonium NH4+ membentuk (NH4)2S2O8 (NH4)2S2O8 dan air H2O.
Reaksi keseluruhannya adalah sebagai berikut:
(NH4)2SO4 + 2 H2SO4 -> (NH4)2S2O8 + 2 H2O + H2 + O2
Dengan pendinginan dan penyaringan, (NH4)2S2O8 dapat dikristalisasi dari larutan elektrolit.
Metode lain untuk membuat (NH4)2S2O8 adalah oksidasi amonium bisulfat NH4HSO4 dengan ozon O3 atau hidrogen peroksida H2O2 . Metode ini menghasilkan rendemen dan kemurnian (NH4)2S2O8 yang lebih tinggi dibandingkan metode elektrolisis. Reaksinya adalah:
NH4HSO4 + O3 -> (NH4)2S2O8 + H2O
Emas
NH4HSO4 + H2O2 -> (NH4)2S2O8 + 2H2O
Kegunaan amonium persulfat
(NH4)2S2O8 merupakan bahan kimia serbaguna yang memiliki banyak kegunaan di berbagai industri dan aplikasi. Beberapa kegunaan yang paling umum adalah:
- Ini berfungsi sebagai zat pemutih dan prekursor kimia dalam sintesis senyawa industri penting lainnya.
- Ini memulai proses polimerisasi dan produsen terutama menggunakannya dalam produksi polistiren.
- Produsen PCB menggunakannya sebagai etsa untuk menghilangkan tembaga dan logam lainnya dari permukaan.
- Industri semikonduktor juga menggunakan (NH4)2S2O8 sebagai etsa untuk membersihkan dan memoles wafer silikon.
- Laboratorium menggunakannya sebagai bahan pembersih dan disinfektan untuk peralatan, peralatan gelas, dan sistem air.
- Ini mencegah pencoklatan pada buah dan sayuran, menjadikannya bahan tambahan yang digunakan untuk mengawetkan makanan.
- Berbagai reaksi kimia menggunakannya sebagai zat pengoksidasi untuk sintesis peroksida organik, sulfon dan sulfonamid.
- Baterai menggunakannya sebagai depolarisasi untuk meningkatkan kinerja dan masa pakainya.
- Pemutih rambut menggunakannya sebagai bahan umum untuk mencerahkan warna rambut dengan mengoksidasi pigmen melanin.
Pertanyaan:
T: Berapa lama amonium persulfat bertahan?
J: (NH4)2S2O8 adalah senyawa stabil yang dapat disimpan dalam keadaan padat tanpa batas waktu tanpa terurai. Namun, efektivitasnya mungkin hilang seiring waktu jika dilarutkan dalam air. Umur simpan larutan (NH4)2S2O8 10% adalah sekitar 2 hingga 4 minggu pada suhu kamar dan 2 hingga 3 bulan pada suhu 4°C 1 2 . Larutan harus terlindung dari cahaya dan panas dan diperiksa secara berkala apakah ada gelembung atau endapan yang menunjukkan dekomposisi.
T: Apa fungsi amonium persulfat?
A: (NH4)2S2O8 adalah zat pengoksidasi kuat yang dapat melepaskan radikal oksigen dalam larutan air. Radikal ini dapat memicu atau mempercepat berbagai reaksi kimia, seperti polimerisasi, pemutihan, etsa, pembersihan, dan desinfeksi. (NH4)2S2O8 juga dapat berperan sebagai sumber ion sulfat untuk sintesis senyawa lain.
T: Untuk apa mencampurkan amonium persulfat?
A: (NH4)2S2O8 sangat larut dalam air dan dapat dicampur dengan air untuk membuat larutan dengan konsentrasi berbeda. Kelarutan (NH4)2S2O8 dalam air meningkat seiring dengan meningkatnya suhu. Pada suhu 25°C dapat melarutkan hingga 80g/100ml air. Ini juga cukup larut dalam metanol. (NH4)2S2O8 tidak boleh dicampur dengan zat yang tidak kompatibel, seperti bahan yang mudah terbakar, zat pereduksi, logam, asam atau basa, karena dapat bereaksi hebat atau meledak dengan bahan tersebut.
T: Apakah amonium peroksidisulfat sama dengan amonium persulfat?
A: Ya, amonium peroksidisulfat adalah nama lain dari (NH4)2S2O8. Keduanya merupakan sinonim dari senyawa yang sama dengan rumus (NH4)2S2O8.
T: Untuk apa amonium persulfat digunakan dalam SDS-PAGE?
A: SDS-PAGE (elektroforesis gel natrium dodesil sulfat poliakrilamida) adalah teknik untuk memisahkan protein berdasarkan ukuran dan muatannya. (NH4)2S2O8 digunakan sebagai katalis untuk polimerisasi monomer akrilamida dan bisakrilamida untuk membentuk matriks gel poliakrilamida. (NH4)2S2O8 menghasilkan radikal bebas yang memulai reaksi ikatan silang antar monomer.
Q: Bagaimana cara membuat 10% amonium persulfat?
A: Untuk menyiapkan larutan 10% (NH4)2S2O8, timbang 10 g padatan (NH4)2S2O8 dan larutkan dalam 90 ml air suling. Aduk hingga larut sempurna dan pindahkan ke labu takar 100 ml. Isi sampai tanda batas dengan air suling dan aduk rata. Simpan larutan dalam botol gelap pada suhu 4°C atau suhu kamar.
T: Bagaimana cara memperbaiki amonium persulfat yang dipicu oleh busur api?
A: Arc flash adalah cacat yang disebabkan oleh busur listrik yang merusak permukaan logam. Hal ini dapat mengurangi kekuatan dan ketahanan korosi pada logam dan menyebabkan retak atau kegagalan. Untuk memperbaiki arc flash, salah satu caranya adalah dengan menggunakan (NH4)2S2O8 sebagai etsa untuk menghilangkan area yang terkena. Prosedurnya adalah sebagai berikut:
- Bersihkan permukaan logam dengan aseton atau alkohol untuk menghilangkan kotoran atau minyak.
- Oleskan lapisan tipis larutan amonium persulfat (10-20%) ke area yang terkena busur api menggunakan kuas atau kapas.
- Tunggu 5 hingga 10 menit hingga muncul gelembung di permukaan yang menandakan sedang terjadi reaksi oksidasi.
- Bilas permukaan dengan air dan keringkan dengan kain bersih.
- Ulangi proses ini sampai busur benar-benar hilang.
- Periksa permukaan apakah ada retakan atau lubang dan isi dengan bahan pengisi yang sesuai jika perlu.
- Oleskan lapisan pelindung atau cat untuk mencegah korosi lebih lanjut.
T: Apakah amonium persulfat merupakan surfaktan?
J: Tidak, (NH4)2S2O8 bukan merupakan surfaktan. Surfaktan adalah zat yang mengurangi tegangan permukaan suatu cairan atau antara dua cairan, dan dapat membentuk misel atau emulsi. (NH4)2S2O8 tidak memiliki sifat ini. Ini adalah zat pengoksidasi yang dapat melepaskan radikal oksigen dalam larutan air.
T: Aspek eksperimen Anda apa yang dikontrol oleh TEMED dan amonium persulfat?
A: TEMED dan (NH4)2S2O8 digunakan untuk mengontrol polimerisasi monomer akrilamida dan bisakrilamida untuk membentuk matriks gel poliakrilamida untuk elektroforesis. TEMED dan (NH4)2S2O8 berperan sebagai katalis penghasil radikal bebas yang memulai dan mempercepat reaksi ikatan silang antar monomer. Konsentrasi dan rasio TEMED dan (NH4)2S2O8 mempengaruhi laju dan kelengkapan polimerisasi, serta ukuran pori dan kekuatan mekanik gel.
T: Apakah amonium persulfat bereaksi dengan udara?
A: Ya, (NH4)2S2O8 dapat bereaksi dengan udara, terutama pada kondisi lembab. (NH4)2S2O8 dapat menyerap uap air dari udara dan mengalami hidrolisis membentuk amonium sulfat dan hidrogen peroksida. Hidrogen peroksida selanjutnya dapat terurai menjadi air dan gas oksigen, melepaskan panas dan tekanan. Hal ini dapat menyebabkan wadah (NH4)2S2O8 pecah atau meledak jika ventilasinya tidak tepat. (NH4)2S2O8 juga dapat bereaksi dengan oksigen di udara membentuk ozon, yang merupakan gas beracun. Oleh karena itu, (NH4)2S2O8 harus disimpan di tempat sejuk, kering, berventilasi baik, jauh dari panas, percikan api, nyala api, dan zat tidak kompatibel lainnya.
