Amonium oksida ((NH4)2O) adalah senyawa kristal putih yang larut dalam air dan bertindak sebagai basa lemah. Ini dihasilkan oleh reaksi amonia dan oksigen dan digunakan dalam pupuk, bahan pembersih dan sebagai alat pemadam kebakaran.
| Nama IUPAC | Amonium oksida |
| Formula molekul | (NH4)2O |
| nomor CAS | 12046-03-6 |
| Sinonim | Amonium hidroksida, larutan amonia, Aqua Amonia |
| Di ChI | InChI=1S/H4N.O/h1H4;/q+1;-1 |
Sifat amonium oksida
Rumus Amonium Oksida
Rumus amonium oksida adalah (NH4)2O. Ini adalah senyawa yang terdiri dari satu atom nitrogen dan empat atom hidrogen dikombinasikan dengan satu atom oksigen.
Massa Molar Amonium Oksida
Massa molar amonium oksida kira-kira 52,07 gram per mol. Ini dihitung dengan menjumlahkan berat atom semua atom yang ada dalam molekul. Massa molar membantu menentukan jumlah partikel yang ada dalam jumlah tertentu suatu zat.
Titik didih amonium oksida
Titik didih (NH4)2O kira-kira 90°C. Ini adalah suhu di mana tekanan uap suatu cairan sama dengan tekanan di sekitarnya, menyebabkan cairan berubah menjadi gas. Titik didih suatu zat merupakan sifat fisik penting yang dapat digunakan untuk mengidentifikasi dan membedakan berbagai senyawa.
Titik leleh amonium oksida
Titik leleh (NH4)2O kira-kira -6°C. Ini adalah suhu di mana zat padat berubah menjadi cairan. Titik leleh suatu zat dapat digunakan untuk mengidentifikasi dan membedakan berbagai senyawa, serta untuk menentukan kemurnian suatu zat.
Massa jenis amonium oksida g/ml
Massa jenis (NH4)2O kira-kira 1,02 g/ml. Massa jenis adalah jumlah massa per satuan volume dan merupakan sifat fisik dasar suatu zat. Massa jenis suatu zat dapat digunakan untuk mengidentifikasi dan membedakan berbagai senyawa, serta untuk menentukan kemurnian suatu zat.
Berat molekul amonium oksida
Berat molekul amonium oksida kira-kira 52,07 g/mol. Ini adalah jumlah berat atom dari semua atom yang ada dalam molekul suatu zat. Berat molekul dapat digunakan untuk menghitung mol suatu zat yang ada dalam suatu massa tertentu dan merupakan sifat fisik penting yang digunakan dalam banyak bidang ilmu pengetahuan.
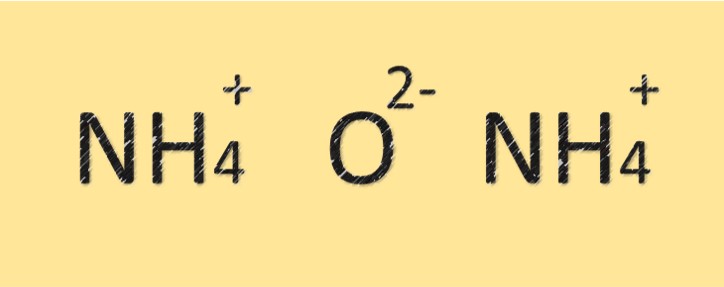
Struktur amonium oksida
Amonium oksida adalah senyawa yang terdiri dari atom nitrogen dan oksigen. Ia memiliki rumus molekul (NH4)2O dan terdiri dari dua atom nitrogen dan satu atom oksigen. Atom nitrogen terikat dengan atom oksigen melalui ikatan kovalen dan juga mempunyai muatan positif. Senyawa tersebut bersifat basa atau basa karena adanya ion amonium.
| Penampilan | Padatan kristal putih |
| Berat jenis | 1,02 gram/cm³ |
| Warna | Putih |
| Bau | Amonia |
| Masa molar | 52,07 g/mol |
| Kepadatan | 1,02 gram/cm³ |
| Titik fusi | -6°C |
| Titik didih | 90°C |
| Titik kilat | T/A |
| Kelarutan dalam air | Larut |
| Kelarutan | Larut dalam air |
| Tekanan uap | T/A |
| Kepadatan uap | T/A |
| pKa | T/A |
| pH | 11.6 (100 g/L, H2O, 20°C) |
Keamanan dan bahaya amonium oksida
(NH4)2O mengiritasi mata, kulit dan sistem pernapasan. Menghirup uapnya dapat menyebabkan batuk, sesak napas, dan iritasi paru-paru. Kontak dengan kulit dapat menyebabkan gatal dan kemerahan. Senyawa tersebut harus ditangani dengan hati-hati dan tindakan perlindungan seperti sarung tangan dan pelindung mata harus digunakan. Jika terkena, area yang terkena harus dibilas dengan air dan perhatian medis harus dicari jika gejalanya terus berlanjut. Bahan ini juga mudah terbakar dan harus dijauhkan dari sumber api.
| Simbol bahaya | Mengiritasi |
| Deskripsi Keamanan | S26-S36/37/39 |
| Nomor identifikasi PBB | UN2672 |
| kode HS | 2841.90.90 |
| Kelas bahaya | 8 |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | Mengiritasi mata, kulit dan sistem pernafasan |
Metode sintesis amonium oksida
(NH4)2O dapat disintesis dengan beberapa metode, termasuk dekomposisi termal amonium nitrat dan reaksi antara gas amonia dan gas oksigen.
Salah satu metodenya melibatkan dekomposisi termal amonium nitrat, yang merupakan pupuk umum. Reaksi tersebut menghasilkan amonia dan nitrogen dioksida, yang kemudian dioksidasi menjadi nitrogen dioksida dan oksida nitrat. Nitrit oksida bereaksi dengan lebih banyak gas amonia membentuk (NH4)2O.
Metode lain melibatkan melewatkan gas amonia di atas katalis yang dipanaskan, menyebabkan atom nitrogen dan oksigen bergabung dan membentuk (NH4)2O. Kedua metode ini menghasilkan (NH4)2O berupa padatan kristal putih, yang dapat dimurnikan melalui rekristalisasi.
Kegunaan amonium oksida
Industri menggunakan (NH4)2O untuk berbagai keperluan karena kandungan amoniumnya yang tinggi dan sifat basa yang kuat. Sebagai pupuk, ia menyediakan sumber nitrogen bagi tanaman. Bahan pembersih menggunakannya untuk melarutkan lemak dan kotoran. Industri metalurgi menggunakannya sebagai zat pereduksi oksida logam, khususnya dalam produksi aluminium. Sebagai zat pendingin, ia digunakan dalam sistem pendingin industri dan sebagai sumber nitrogen dalam produksi asam nitrat. Di laboratorium, ahli kimia menggunakannya sebagai sumber amonia untuk reaksi kimia. Fleksibilitas (NH4)2O menjadikannya bahan kimia berharga dengan banyak aplikasi di semua sektor.
