Amonium karbonat ((NH4)2CO3) adalah garam. Ini terbentuk ketika amonia dan karbon dioksida bereaksi. Banyak kegunaannya, seperti membuat kue dan mencium bau garam.
| Nama IUPAC | Amonium karbonat |
| Formula molekul | (NH4)2CO3 |
| nomor CAS | 506-87-6 |
| Sinonim | amonia pembuat roti, garam mudah menguap, garam hartshorn, E503 |
| Di ChI | InChI=1S/CH2O3.2H3N/c2-1(3)4;;/h(H2,2,3,4);2*1H3 |
Sifat amonium karbonat
Formula Amonium Karbonat
Rumus kimia atau rumus molekul amonium karbonat adalah (NH4)2CO3 1 . Ini adalah garam yang terdiri dari dua ion amonium dan satu ion karbonat. Dapat dituliskan NH4+ + NH4+ + CO3 2- untuk menunjukkan muatan ion-ionnya.
Massa Molar Amonium Karbonat
Massa molar (NH4)2CO3 adalah 96,09 g/mol 2 . Untuk menghitung massa molar, kita perlu menjumlahkan massa atom semua atom dalam rumus. Massa atom adalah:
- Nitrogen: 14,01 g/mol
- Hidrogen: 1,01 g/mol
- Karbon: 12,01 g/mol
- Oksigen: 16,00 g/mol
Jadi, massa molar amonium karbonat adalah:
(2 x 14,01) + (8 x 1,01) + 12,01 + (3 x 16,00) = 96,09 g/mol
Titik didih amonium karbonat
(NH4)2CO3 tidak memiliki titik didih karena terurai sebelum mencapai suhu tersebut. Ketika dipanaskan, ia terurai menjadi amonia dan karbon dioksida, yang keluar dari padatan. Reaksi penguraiannya adalah:
(NH4)2CO3 -> 2NH3 + CO2 + H2O
Suhu dekomposisi tergantung pada kelembaban dan tekanan lingkungan, tetapi umumnya sekitar 60°C.
Titik lebur amonium karbonat
(NH4)2CO3 memiliki titik leleh 58°C (136°F; 331 K). Namun, ia juga terurai pada suhu ini dan karenanya tidak membentuk fase cair. Sebaliknya, ia menyublim langsung dari padat menjadi gas.
Kepadatan Amonium Karbonat g/ml
Massa jenis (NH4)2CO3 adalah 1,50 g/ml. Massa jenis adalah massa per satuan volume suatu zat. Untuk menghitung massa jenis, bagi massa dengan volume. Misalnya, jika kita mempunyai 10 g (NH4)2CO3 dan menempati ruang 6,67 ml, maka massa jenisnya adalah:
10g / 6,67ml = 1,50g/ml
Berat Molekul Amonium Karbonat
Berat molekul (NH4)2CO3 sama dengan massa molarnya, yaitu 96,09 g/mol. Berat molekul dan massa molar sering digunakan secara bergantian, namun memiliki arti yang sedikit berbeda. Berat molekul adalah massa satu molekul suatu zat, sedangkan massa molar adalah massa satu mol (6,022 x 10^23 molekul) suatu zat.
Struktur amonium karbonat
Struktur (NH4)2CO3 dapat direpresentasikan dengan struktur titik Lewis atau model bola-dan-tongkat. Struktur titik Lewis menunjukkan elektron valensi setiap atom dan bagaimana elektron tersebut dibagikan atau ditransfer untuk membentuk ikatan. Model bola-dan-tongkat menunjukkan bentuk dan susunan atom serta ikatan dalam tiga dimensi.
Berikut kemungkinan struktur titik Lewis untuk amonium karbonat:
OOOO
|| || ||
HNH HNH HCH
| | |
HHH
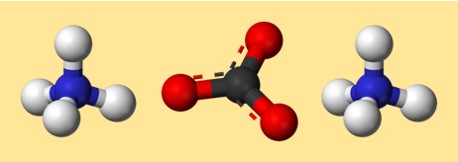
Berikut adalah model yang mungkin untuk amonium karbonat:
Dalam model ini, setiap warna mewakili elemen berbeda:
- Abu-abu: karbon
- Merah: oksigen
- Biru: nitrogen
- Putih: hidrogen
Kelarutan amonium karbonat
(NH4)2CO3 larut dalam air. Kelarutan adalah kemampuan suatu zat untuk larut dalam zat lain. Ketika (NH4)2CO3 dilarutkan dalam air, ia membentuk ion berair yang dapat berinteraksi dengan ion atau molekul lain dalam larutan. Reaksi pembubarannya adalah:
(NH4)2CO3 + H2O -> 2 NH4+ + CO3 2- + H2O
Kelarutan (NH4)2CO3 bergantung pada suhu dan pH air. Pada suhu yang lebih tinggi, lebih banyak (NH4)2CO3 yang dapat larut dalam air.
| Penampilan | bubuk putih |
| Kepadatan spesifik | 1,50 |
| Warna | Tanpa warna |
| Bau | Bau amonia yang menyengat |
| Masa molar | 96,09 g/mol |
| Kepadatan | 1,50g/ml |
| Titik fusi | 58°C (136°F; 331K) |
| Titik didih | Rusak sebelum direbus |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | 100g/100ml (15°C) |
| Kelarutan | Larut dalam air, alkohol dan aseton |
| Tekanan uap | Tidak tersedia |
| Kepadatan uap | Tidak tersedia |
| pKa | 9,25 (untuk NH4+) |
| pH | 7.8 (untuk solusi 0,1M) |
Keamanan dan bahaya amonium karbonat
(NH4)2CO3 merupakan zat berbahaya yang dapat menyebabkan iritasi dan kerusakan pada kulit, mata, hidung, tenggorokan, dan paru-paru. Mungkin juga berbahaya jika tertelan. Ini harus ditangani dengan hati-hati dan dengan alat pelindung diri, seperti sarung tangan, kacamata dan masker. Itu harus disimpan di tempat yang sejuk, kering, berventilasi baik, jauh dari panas, percikan api dan nyala api. Ini tidak boleh dicampur dengan asam kuat, basa atau zat pereduksi, karena dapat bereaksi keras atau melepaskan gas beracun. Jika terpapar, segera dapatkan bantuan medis.
| Simbol bahaya | Xi (Menjengkelkan) |
| Deskripsi Keamanan | S22: Jangan menghirup debu. S24/25: Hindari kontak dengan kulit dan mata. |
| Nomor identifikasi PBB | UN3077 |
| kode HS | 28369910 |
| Kelas bahaya | 9 |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | Tikus LD50 oral: 2000 mg/kg |
Metode sintesis amonium karbonat
Metode yang berbeda dapat mensintesis (NH4)2CO3, bergantung pada bahan awal dan kemurnian produk yang diinginkan. Berikut beberapa contoh metode sintesis (NH4)2CO3:
- Salah satu metodenya melibatkan mereaksikan amonium sulfat dengan amonium klorida dan kalsium karbonat dalam oven. Reaksi tersebut menghasilkan (NH4)2CO3 dan kalsium klorida sebagai produk sampingan. Reaksinya adalah:
(NH4)2SO4 + 2 NH4Cl + CaCO3 -> 2 (NH4)2CO3 + CaCl2
- Metode lain melibatkan reaksi dengan karbon dioksida dan amonia dalam larutan air. Reaksi tersebut menghasilkan (NH4)2CO3 dan air sebagai produk sampingan. Reaksinya adalah:
CO2 + 2 NH3 + H2O -> (NH4)2CO3 + H2O
- Metode ketiga melibatkan pemaparan larutan amonium ke udara yang mengandung karbon dioksida. Amonium bikarbonat adalah produk reaksi dan pemanasan dapat memecahnya lebih lanjut menjadi (NH4)2CO3.
Reaksinya adalah:
NH3 + CO2 + H2O -> NH4HCO3
NH4HCO3 -> NH3 + CO2 + H2O
(NH4)2CO3 -> (NH4)2CO3
- Paparan amonium bikarbonat ke udara menghasilkan (NH4)2CO3 untuk penggunaan komersial. Amonium bikarbonat terurai menjadi amonia dan karbon dioksida, yang bereaksi kembali membentuk (NH4)2CO3. Prosesnya adalah:
NH4HCO3 -> NH3 + CO2
NH3 + CO2 -> (NH4)2CO3
Kegunaan amonium karbonat
(NH4)2CO3 memiliki berbagai kegunaan di berbagai bidang, seperti:
- Pembuat roti menggunakannya sebagai bahan pengawet, terutama untuk biskuit dan kerupuk yang pipih atau renyah. Ini menghasilkan gas karbon dioksida dan amonia yang membantu adonan mengembang dan menciptakan tekstur ringan. Ini juga meningkatkan rasa dan aroma makanan yang dipanggang.
- Orang menggunakannya sebagai garam beraroma untuk menghidupkan kembali orang yang pingsan atau merasa tidak bahagia. Ini merangsang sistem pernapasan dan meningkatkan tekanan darah dengan melepaskan uap amonia yang mengiritasi hidung dan paru-paru.
- Beberapa sirup obat batuk dan ekspektoran, seperti Sirup Batuk Buckley, menggunakannya sebagai bahan aktif. Membantu mengencerkan dan mengeluarkan dahak dari dada dan tenggorokan dengan meningkatkan sekresi lendir.
- Dokter menggunakannya sebagai obat muntah untuk menginduksi muntah jika terjadi keracunan atau overdosis. Ini mengiritasi lapisan perut dan menyebabkan mual dan muntah dengan melepaskan karbon dioksida.
- Ahli kimia menggunakannya sebagai reagen dalam beberapa reaksi kimia, seperti sintesis urea, amonium nitrat, dan amonium sulfat. Ini juga bertindak sebagai buffer untuk menjaga pH larutan.
Pertanyaan:
T: Apakah amonium karbonat bersifat asam atau basa?
A: (NH4)2CO3 adalah garam yang dapat bereaksi dengan asam dan basa. Ketika dilarutkan dalam air, ia membentuk ion amonium dan ion karbonat. Ion amonium dapat bertindak sebagai asam lemah dan menyumbangkan proton ke air, sedangkan ion karbonat dapat bertindak sebagai basa lemah dan menerima proton dari air. PH larutan bergantung pada kekuatan relatif ion amonium dan ion karbonat. Jika ion karbonat merupakan basa yang lebih kuat dibandingkan ion amonium yang bersifat asam, maka larutan akan bersifat basa. Larutan akan bersifat asam jika ion amonium merupakan asam yang lebih kuat dibandingkan dengan ion karbonat yang bersifat basa. Jika ion amonium dan ion karbonat mempunyai kekuatan yang sama, maka larutan akan bersifat netral.
T: Apakah amonium karbonat termasuk garam?
A: Ya, (NH4)2CO3 adalah garam. Garam adalah senyawa yang terbentuk ketika asam dan basa saling menetralkan. (NH4)2CO3 dapat terbentuk ketika amonia, basa lemah, bereaksi dengan asam karbonat, asam lemah. Reaksinya adalah:
2NH3 + H2CO3 -> (NH4)2CO3 + H2O
Amonia dan asam karbonat merupakan basa induk dan asam dari (NH4)2CO3.
Q: Apakah amonium karbonat (aq) mempunyai bau dalam bentuk air?
A: Ya, (NH4)2CO3 (aq) berbau air. Bau tersebut disebabkan oleh keluarnya gas amonia dari larutan. Gas amonia memiliki bau yang menyengat sehingga dapat mengiritasi hidung dan paru-paru. Gas amonia dapat keluar dari larutan karena mudah menguap dan memiliki kelarutan yang rendah dalam air. Banyaknya gas amonia yang dilepaskan tergantung pada suhu dan konsentrasi larutan.
Q: Jenis atom apakah amonium karbonat itu?
J: (NH4)2CO3 bukanlah sebuah atom, melainkan sebuah molekul. Molekul adalah sekelompok atom yang dihubungkan bersama dengan berbagi elektron. Atom adalah unit terkecil suatu materi dengan identitas kimia tertentu. (NH4)2CO3 adalah molekul yang terdiri dari empat jenis atom berbeda: nitrogen, hidrogen, karbon, dan oksigen. Rumus molekul (NH4)2CO3 adalah (NH4)2CO3.
Q: Berapa jumlah mol amonium karbonat?
J: Untuk menjawab pertanyaan ini, kita perlu mengetahui berapa banyak (NH4)2CO3 yang kita miliki dalam hal massa atau volume. Mol adalah satuan ukuran yang mewakili 6,022 x 10^23 partikel suatu zat. Jumlah mol suatu zat dapat dihitung dengan membagi massanya dengan massa molarnya atau dengan mengalikan volumenya dengan molaritasnya. Massa molar (NH4)2CO3 adalah 96,09 g/mol. Molaritas (NH4)2CO3 bergantung pada kelarutannya dalam air.
Misalnya, jika kita mempunyai 10 g (NH4)2CO3, kita dapat mencari jumlah mol dengan membagi 10 g dengan 96,09 g/mol:
10 g / 96,09 g/mol = 0,104 mol
Jika kita mempunyai 100 ml larutan 0,1 M (NH4)2CO3, kita dapat mencari jumlah mol dengan mengalikan 100 ml dengan 0,1 mol/L:
100 ml x 0,1 mol/L = 0,01 mol
Q: Apa rumus kimia amonium karbonat?
A: Rumus kimia amonium karbonat adalah (NH4)2CO3. Rumus ini menunjukkan bahwa molekul (NH4)2CO3 mengandung dua ion amonium (NH4+) dan satu ion karbonat (CO3 2-). Muatan ion-ionnya seimbang, sehingga muatan keseluruhan molekulnya adalah nol.
Q: Berapa mol ion amonium dalam 6,995 g amonium karbonat?
J: Untuk menjawab pertanyaan ini, kita perlu mengikuti dua langkah:
- Pertama, kita perlu menentukan berapa mol (NH4)2CO3 dalam 6,995 g dengan membagi 6,995 g dengan massa molarnya (96,09 g/mol):
6,995 g / 96,09 g/mol = 0,0728 mol
- Kedua, kita perlu mengalikan angka ini dengan dua, karena setiap mol (NH4)2CO3 mengandung dua mol ion amonium:
0,0728 mol x 2 = 0,1456 mol
Oleh karena itu terdapat 0,1456 mol ion amonium dalam 6,995 g (NH4)2CO3.
Q: Gas apa yang dihasilkan ketika asam klorida bereaksi dengan amonium karbonat?
A: Ketika asam klorida bereaksi dengan (NH4)2CO3, asam klorida mengalami reaksi perpindahan ganda menghasilkan amonium klorida dan asam karbonat. Asam karbonat kemudian terurai menjadi air dan karbon dioksida. Karbon dioksida adalah gas yang dihasilkan oleh reaksi ini. Persamaan keseluruhan untuk reaksi ini adalah sebagai berikut:
(NH4)2CO3 + 2 HCl -> 2 NH4Cl + H2CO3
H2CO3 -> H2O + CO2
Persamaan ionik bersih untuk reaksi ini adalah:
CO3 2- + 2 H+ -> H2O + CO2
