Amonium bifluorida (NH5F2) adalah senyawa kimia. Ini larut dalam air dan membentuk asam fluorida. Ini dapat menyerang kaca dan menimbulkan korosi pada logam.
| Nama IUPAC | Hidrogen amonium fluorida |
| Formula molekul | [NH4] [HF2] |
| nomor CAS | 1341-49-7 |
| Sinonim | Asam amonium fluorida, amonium hidrofluorida, amonium difluorida, amonium hidrogen difluorida, amonium hidrogen difluorida |
| Di ChI | InChI=1S/F2H.H3N/c1-3-2;/h;1H3/q-1;/p+1 |
Sifat amonium bifluorida
Formula Amonium Bifluorida
Rumus amonium bifluorida adalah [NH4][HF2] atau [NH4]F·HF. Hal ini menunjukkan bahwa senyawa tersebut mengandung kation amonium ([NH4]+) dan anion bifluorida atau hidrogen (difluorida) ([HF2]−). Rumusnya juga dapat ditulis sebagai NH5F2, yang menunjukkan jumlah atom setiap unsur dalam senyawa.
Massa Molar Amonium Bifluorida
Massa molar amonium difluorida adalah 57,044 g/mol. Dihitung dengan menjumlahkan massa atom unsur-unsur dalam rumus: (14,007 + 4 × 1,008) + (2 × 18,998) = 57,044 g/mol.
Titik didih amonium bifluorida
Titik didih amonium difluorida adalah 240 °C (464 °F; 513 K). Namun, senyawa tersebut terurai sebelum mencapai suhu ini, melepaskan gas amonia dan hidrogen fluorida 1 . Oleh karena itu, amonium difluorida tidak memiliki titik didih yang sebenarnya.
Titik lebur amonium bifluorida
Titik leleh amonium difluorida adalah 126 °C (259 °F; 399 K). Ini adalah suhu di mana senyawa padat berubah menjadi cair. Titik leleh bergantung pada kekuatan gaya antarmolekul antar molekul senyawa.
Massa jenis amonium bifluorida g/ml
Massa jenis amonium difluorida adalah 1,50 g/ml. Ini adalah massa senyawa per satuan volume. Kepadatan dapat diukur dengan membagi massa suatu sampel dengan volumenya. Massa jenis suatu zat bergantung pada struktur molekul dan kemasannya.
Berat Molekul Amonium Bifluorida
Berat molekul amonium difluorida adalah 57,044 g/mol. Ini sama dengan massa molar senyawa tersebut. Berat molekul dapat digunakan untuk menghitung jumlah mol suatu zat dalam massa atau volume tertentu.
Struktur amonium bifluorida
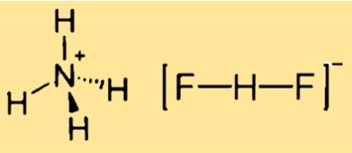
Struktur amonium difluorida berbentuk kubik, berhubungan dengan struktur CsCl. Artinya senyawa tersebut mempunyai kisi kristal dengan sel satuan kubik, dimana setiap kation amonium dikelilingi oleh empat pusat fluorida dalam tetrahedron, dan setiap anion difluorida berbentuk linier. Strukturnya dapat direpresentasikan dengan model tiga dimensi atau diagram dua dimensi.
Kelarutan amonium bifluorida
Kelarutan amonium difluorida dalam air adalah 63 g/100 ml pada 20°C. Artinya 63 gram senyawa tersebut dapat larut dalam 100 mililiter air pada suhu tersebut. Kelarutan tergantung pada polaritas dan kapasitas ikatan hidrogen senyawa dan pelarut.
| Penampilan | Kristal tidak berwarna atau kristal putih |
| Kepadatan spesifik | 1,50 |
| Warna | Tanpa warna |
| Bau | Sedikit pedas, pedas |
| Masa molar | 57,044 g/mol |
| Kepadatan | 1,50 gram/cm3 |
| Titik fusi | 126°C (259°F; 399K) |
| Titik didih | 240 °C (464 °F; 513 K) (terurai) |
| Titik kilat | Tidak mudah terbakar |
| Kelarutan dalam air | 63g/100ml (20°C) |
| Kelarutan | Sedikit larut dalam alkohol, tidak larut dalam amonia cair |
| Tekanan uap | Tidak tersedia |
| Kepadatan uap | Tidak tersedia |
| pKa | Tidak tersedia |
| pH | Tidak tersedia |
Keamanan dan bahaya amonium bifluorida
Amonium difluorida adalah bahan kimia beracun dan korosif yang dapat membahayakan Anda jika Anda menelan, menghirup, atau menyentuhnya. Hal ini dapat menyebabkan luka bakar parah dan kerusakan mata, mimisan, batuk, mengi, sesak napas, mual, muntah dan kehilangan nafsu makan. Ia juga dapat melepaskan hidrogen fluorida saat dipanaskan, yang sangat berbahaya jika terhirup. Anda harus menghindari kontak dengan bahan kimia ini dan mengenakan sarung tangan pelindung, pakaian, pelindung mata dan wajah saat menanganinya. Jika Anda terkena, sebaiknya segera bilas dengan air dan cari pertolongan medis. Anda juga harus mencuci pakaian yang terkontaminasi sebelum menggunakannya kembali.
| Simbol bahaya | T, C |
| Deskripsi Keamanan | S26, S36/37/39, S45 |
| Nomor identifikasi PBB | UN 1727 (padat), UN 2817 (solusi) |
| kode HS | 2826.19 |
| Kelas bahaya | 8 |
| Kelompok pengepakan | II |
| Toksisitas | LD50 oral (tikus) = 200 mg/kg |
Metode sintesis amonium bifluorida
Metode berbeda digunakan untuk menyiapkan amonium difluorida, garam anorganik. Beberapa metode yang umum adalah:
- Proses Fase Uap: Metode ini melibatkan reaksi gas amonia dan gas hidrogen fluorida pada suhu dan tekanan tinggi. Produknya adalah bubuk amonium difluorida kering dan murni. Namun cara ini memerlukan peralatan yang rumit dan investasi yang tinggi.
- Metode fase cair: Metode ini melibatkan reaksi larutan amonia dan hidrogen fluorida atau amonium fluorida dan asam fluorida dalam air pada suhu dan tekanan sedang. Produknya adalah kristal amonium difluorida yang lembab dan kurang murni. Orang banyak menggunakan cara ini karena sederhana, tetapi kualitas produknya buruk dan cenderung menyerap kelembapan dan kue.
- Metode netralisasi: Metode ini melibatkan reaksi larutan tak jenuh amonium fluorida dan asam fluorida , diikuti dengan penambahan larutan amonia untuk menetralkan kelebihan asam fluorida. Produknya adalah kristal amonium difluorida yang relatif murni dan stabil. Cara ini dapat meningkatkan kualitas produk dan mengurangi pencemaran lingkungan.
Kegunaan amonium bifluorida
Amonium difluorida adalah garam anorganik yang memiliki berbagai kegunaan di berbagai industri. Beberapa kegunaan umum adalah:
- Kaca Etsa: Amonium difluorida dapat menyerang komponen silika kaca dan menciptakan pola atau desain pada permukaan. Dapat juga menghilangkan noda dan karat pada peralatan gelas.
- Pemrosesan Logam: Amonium difluorida dapat bertindak sebagai zat pengompleks dengan logam tertentu dan meningkatkan kualitas dan tampilan pelapisan listrik. Itu juga dapat menghilangkan oksida dan kerak dari permukaan logam.
- Produksi keramik: digunakan sebagai fluks dalam pembuatan glasir dan enamel keramik. Hal ini juga dapat menurunkan titik leleh dan viskositas bahan keramik tertentu.
- Sintesis organik: Digunakan sebagai katalis atau reagen dalam reaksi organik tertentu, seperti fluorinasi, deproteksi, dan pembelahan.
- Pencernaan Mineral: Juga digunakan sebagai zat fluorinasi yang kuat untuk mengubah mineral tertentu dan oksida tahan api menjadi fluorida yang larut. Hal ini dapat memfasilitasi perolehan logam mulia dari bijihnya.
Pertanyaan:
T: Berapa massa jenis garam amonium bifluorida?
A: Massa jenis garam amonium difluorida adalah 1,5 g/cm3.
T: Untuk apa amonium bifluorida digunakan?
A: Amonium difluorida digunakan untuk berbagai keperluan, seperti etsa kaca, pemrosesan logam, produksi keramik, sintesis organik, dan pencernaan mineral.
T: Bagaimana cara mengetsa kaca dengan amonium bifluorida?
A: Untuk mengetsa kaca dengan amonium difluorida, Anda perlu menyiapkan larutan garam dalam air dan mengoleskannya ke permukaan kaca dengan kuas atau stensil. Solusinya akan bereaksi dengan komponen silika pada kaca dan menciptakan pola atau desain. Anda perlu membilas gelas dengan air dan mengeringkannya setelah digores.
T: Apakah amonium bifluorida aman pada roda krom?
J: Amonium difluorida tidak aman pada roda krom karena dapat menimbulkan korosi pada logam dan merusak lapisan akhir. Bahan ini juga dapat menyebabkan luka bakar parah dan kerusakan mata jika terkena kulit atau mata. Anda sebaiknya menghindari penggunaan amonium difluorida pada roda krom dan sebagai gantinya gunakan pembersih yang sesuai.
T: Berapa umur simpan amonium bifluorida?
J: Umur simpan amonium difluorida bergantung pada kondisi penyimpanan dan kemurnian produk. Umumnya dapat bertahan hingga beberapa tahun jika disimpan di tempat sejuk, kering, berventilasi baik, dan dalam wadah tertutup rapat. Namun, ia dapat menyerap kelembapan dari udara dan lama kelamaan membentuk gumpalan atau kue. Anda harus memeriksa penampilan dan kualitas produk sebelum menggunakannya.
T: Apakah amonium bifluorida termasuk asam?
A: Amonium difluorida bukanlah suatu asam, melainkan suatu garam yang mengandung kation amonium ([NH4]+) dan anion difluorida atau hidrogen (difluorida) ([HF2]−). Namun, ia dapat bertindak sebagai senyawa asam-basa, karena dapat melepaskan hidrogen fluorida (HF), asam kuat, ketika dipanaskan atau dilarutkan dalam air.
