Amonium asetat merupakan senyawa yang digunakan di berbagai industri. Ia bertindak sebagai sumber ion asetat dan berperan dalam reaksi kimia dan sintesis organik.
| Nama IUPAC | Amonium asetat |
| Formula molekul | C2H7NO2 |
| nomor CAS | 631-61-8 |
| Sinonim | Garam amonium dari asam asetat, amonium etanoat, asam amonium asetat, asam asetat, garam amonium |
| Di ChI | InChI=1S/C2H4O2.H3N/c1-2(3)4;/h1H3,(H,3,4);1H3 |
Sifat amonium asetat
Formula Amonium Asetat
Rumus garam amonium dari asam asetat adalah C2H7NO2. Ini terdiri dari dua atom karbon, tujuh atom hidrogen, satu atom nitrogen dan dua atom oksigen.
Massa Molar Amonium Asetat
Massa molar garam amonium asam asetat dihitung dengan menjumlahkan massa atom unsur penyusunnya. Ini kira-kira 77,0825 gram per mol.
Titik didih amonium asetat
Garam amonium dari asam asetat memiliki titik didih sekitar 117 derajat Celcius. Pada suhu tersebut, senyawa mengalami perubahan fasa dari cair menjadi gas.
Titik lebur amonium asetat
Titik leleh garam amonium dari asam asetat kira-kira 114 derajat Celcius. Ini adalah suhu di mana senyawa padat berubah menjadi cair.
Massa jenis amonium asetat g/mL
Massa jenis garam amonium dari asam asetat kira-kira 1,17 gram per mililiter. Ini adalah ukuran massa per satuan volume senyawa.
Berat Molekul Amonium Asetat
Berat molekul garam amonium dari asam asetat kira-kira 77,0825 gram per mol. Ini adalah jumlah berat atom dari semua atom yang ada dalam senyawa.
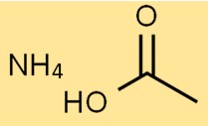
Struktur amonium asetat
Struktur garam amonium asam asetat terdiri dari satu ion NH4+ dan satu ion CH3COO-. Ion NH4+ bermuatan positif, sedangkan ion CH3COO- bermuatan negatif.
Kelarutan amonium asetat
Garam amonium dari asam asetat sangat larut dalam air. Ini mudah larut dalam air untuk membentuk larutan bening dan tidak berwarna. Kelarutan garam amonium asam asetat dalam air disebabkan oleh kemampuannya membentuk ikatan hidrogen dengan molekul air.
| Penampilan | Padatan kristal putih |
| Berat jenis | 1,17g/ml |
| Warna | Tanpa warna |
| Bau | Tidak berbau |
| Masa molar | 77,0825 g/mol |
| Kepadatan | 1,17g/ml |
| Titik fusi | 114°C |
| Titik didih | 117°C |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | sangat larut dalam air |
| Kelarutan | Larut dalam air, asam asetat, etanol |
| Tekanan uap | Tidak tersedia |
| Kepadatan uap | Tidak tersedia |
| pKa | 4.75 |
| pH | Sekitar 6.0-7.0 |
Keamanan dan bahaya amonium asetat
Garam amonium dari asam asetat menimbulkan risiko keamanan minimal jika ditangani dengan benar. Penggunaannya umumnya dianggap aman dalam berbagai aplikasi. Namun, seperti halnya bahan kimia lainnya, tindakan pencegahan harus dilakukan. Hindari menghirup debu atau uapnya, karena dapat menyebabkan iritasi saluran pernapasan. Dianjurkan untuk memakai alat pelindung diri yang sesuai, termasuk sarung tangan dan kacamata pengaman, saat bekerja dengan garam amonium dari asam asetat. Jika tertelan secara tidak sengaja atau terkena mata atau kulit, bilas dengan banyak air dan konsultasikan dengan dokter jika perlu. Simpan garam amonium dari asam asetat di tempat sejuk dan kering, jauh dari bahan yang tidak kompatibel. Ikuti prosedur penanganan dan pembuangan yang benar untuk memastikan keamanan.
| Simbol bahaya | Tidak ada |
| Deskripsi Keamanan | Toksisitas rendah |
| Nomor identifikasi PBB | Tidak diatur |
| kode HS | 2915.29.10 |
| Kelas bahaya | Garam amonium dari asam asetat tidak diklasifikasikan |
| Kelompok pengepakan | Tak dapat diterapkan |
| Toksisitas | Toksisitas rendah |
Metode sintesis amonium asetat
Ada beberapa metode untuk mensintesis garam amonium dari asam asetat. Pendekatan yang umum adalah dengan mencampurkan asam asetat dengan larutan amonium karbonat dalam air. Reaksi antara keduanya menghasilkan garam amonium dan air asetat. Metode ini memerlukan pengendalian suhu dan tekanan selama reaksi.
Dalam metode lain, ahli kimia secara bertahap menambahkan asam asetat ke dalam larutan amonia sambil diaduk hingga pH yang diinginkan tercapai. Proses netralisasi ini mengubah asam asetat menjadi garam amonium dari asam asetat. Pencampuran yang hati-hati dan kontrol pH sangat penting selama reaksi ini.
Gunakan amonium hidroksida untuk mensintesis garam amonium dari asam asetat dengan menggabungkannya dengan asam asetat , menghasilkan pembentukan garam amonium dari asam asetat dan air. Pantau kemajuan reaksi ini sampai selesai.
Campurkan asetat anhidrida dengan amonium hidroksida atau amonia untuk membuat garam amonium dari asam asetat. Reaksi antara reagen ini menghasilkan pembentukan garam amonium dari asam asetat.
Ingatlah bahwa penting untuk melakukan sintesis garam amonium dari asam asetat di area yang berventilasi baik dan mengikuti langkah-langkah keamanan yang sesuai. Sepanjang proses sintesis, pastikan penanganan dan penyimpanan bahan kimia dengan benar.
Kegunaan Amonium Asetat
Garam amonium dari asam asetat menemukan berbagai aplikasi di berbagai industri karena sifatnya yang serbaguna. Berikut beberapa kegunaan umum:
- Garam amonium dari larutan buffer asam asetat dan menjaga tingkat pH stabil di laboratorium kimia dan biologi.
- Metode analisis seperti kromatografi dan spektrometri massa menggunakan garam amonium dari asam asetat sebagai reagen untuk ionisasi dan pemisahan senyawa.
- Biologi molekuler menggunakan garam amonium dari asam asetat untuk mengendapkan DNA selama prosedur pemurnian, sehingga menghilangkan kontaminan dan kotoran.
- Garam amonium dari asam asetat berpartisipasi dalam banyak reaksi kimia, bertindak sebagai sumber ion asetat dalam sintesis organik, reaksi esterifikasi dan proses katalitik.
- Di bidang pertanian, garam amonium dari asam asetat berfungsi sebagai sumber nitrogen dalam pupuk, mendorong pertumbuhan dan perkembangan tanaman.
- Industri tekstil menggunakan garam amonium dari asam asetat untuk mewarnai dan mencetak kain, sehingga meningkatkan ketahanan luntur warna dengan mengikat pewarna pada kain.
- Industri makanan menyetujui garam amonium dari asam asetat sebagai bahan tambahan makanan, yang mengatur keasaman untuk mengontrol pH berbagai produk makanan.
- Dalam teknik analisis kimia seperti HPLC (kromatografi cair kinerja tinggi), garam amonium dari asam asetat memfasilitasi pemisahan dan deteksi senyawa.
Secara keseluruhan, garam amonium dari asam asetat merupakan senyawa serbaguna dengan kegunaan mulai dari aplikasi laboratorium hingga pertanian dan industri makanan. Sifatnya yang unik menjadikannya bahan penting dalam berbagai proses dan produk.
Pertanyaan:
Q: Berapa jumlah atom hidrogen dalam molekul amonium asetat, NH4C2H3O2?
A: Ada empat atom hidrogen dalam satu molekul garam amonium asam asetat (NH4C2H3O2).
T: Apakah amonium asetat larut?
A: Ya, garam amonium dari asam asetat larut dalam air.
Q: Apa rumus amonium asetat?
A: Rumus garam amonium dari asam asetat adalah NH4C2H3O2.
Q: Apakah amonium asetat larut dalam air?
A: Ya, garam amonium dari asam asetat larut dalam air.
T: Bagaimana cara menyiapkan 1M amonium asetat?
A: Untuk menyiapkan garam amonium dari asam asetat 1M, larutkan amonium asetat dalam jumlah yang sesuai dalam air untuk mendapatkan konsentrasi 1 mol per liter (M).
Q: Berapa mol total ion yang dilepaskan ketika 0,624 mol amonium asetat dilarutkan dalam air?
A: Ketika 0,624 mol garam amonium asam asetat dilarutkan dalam air, total 1,248 mol ion (NH4+ dan C2H3O2-) dilepaskan.
Q: Berapa berat molekul tepatnya amonium asetat (NH4OAc)?
A: Berat molekul pasti garam amonium asam asetat (NH4OAc) adalah sekitar 77,0825 gram per mol.
Q: Bagaimana cara membuat amonium asetat 5M?
A: Untuk menyiapkan garam amonium dari asam asetat 5M, larutkan amonium asetat dalam jumlah yang sesuai dalam air hingga mencapai konsentrasi 5 mol per liter (M).
Q: Berapa pKa asam asetat dan pKb amonium hidroksida?
A: PKa asam asetat kira-kira 4,75 dan pKb garam amonium asam asetat kira-kira 4,25.
