Asam kromat adalah zat pengoksidasi kuat dan korosif yang digunakan dalam berbagai aplikasi, seperti pembersihan logam, pengukiran, dan beberapa eksperimen laboratorium. Warnanya merah.
| Nama IUPAC | Asam kromat |
| Formula molekul | H2CrO4 |
| nomor CAS | 7738-94-5 |
| Sinonim | Asam kromium (VI), asam kromium, dihidroksidioksidokrom, dihidrogen (tetraoksidokromat) |
| Di ChI | InChI=1S/Cr.H2O4/c;1-5(2,3)4/jam;(H2,1,2,3,4)/q+2;/p-2 |
Sifat Asam Kromat
Rumus Asam Kromat
Rumus kimia asam kromium adalah H2CrO4. Ini terdiri dari dua atom hidrogen, satu atom kromium dan empat atom oksigen. Rumusnya mewakili komposisi asam kromium pada tingkat molekuler.
Massa Molar Asam Kromat
Massa molar asam kromium dapat dihitung dengan menjumlahkan massa atom unsur-unsur penyusunnya. Kromium memiliki massa atom 51,996 gram per mol, hidrogen memiliki massa molar 1,008 gram per mol, dan oksigen memiliki massa molar 16,00 gram per mol. Oleh karena itu, massa molar asam kromium kira-kira 118,00 gram per mol.
Titik didih asam kromat
Asam kromium tidak memiliki titik didih yang jelas karena terurai ketika dipanaskan dan melepaskan gas oksigen. Namun, suhu dekomposisinya sekitar 190°C (374°F). Ketika dipanaskan, asam kromium mengalami reaksi kimia yang menghasilkan pembentukan kromium trioksida dan air.
Titik Leleh Asam Kromat
Titik leleh asam kromium tidak dapat ditentukan dengan jelas karena kecenderungannya terurai sebelum meleleh. Namun, diketahui bahwa asam kromium dapat terurai pada suhu 250°C (482°F) atau bahkan lebih rendah lagi, bergantung pada kondisi.
Massa jenis asam kromat g/mL
Asam kromium memiliki kepadatan sekitar 1,2 gram per mililiter (g/mL) pada suhu kamar. Nilai densitas ini menunjukkan bahwa asam kromium relatif lebih padat dibandingkan air.
Berat Molekul Asam Kromat
Berat molekul asam kromium dihitung dengan menjumlahkan massa atom unsur penyusunnya. Dalam hal ini, berat molekulnya kira-kira 118,00 gram per mol.
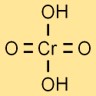
Struktur Asam Kromat
Struktur asam kromium diwakili oleh atom kromium pusat yang terikat pada empat atom oksigen dan dua atom hidrogen. Atom oksigen tersusun mengelilingi atom kromium dalam bentuk tetrahedral.
Kelarutan asam kromat
Asam kromium cukup larut dalam air, yang berarti dapat larut sampai batas tertentu. Kelarutan meningkat dengan meningkatnya suhu. Namun, harus ditangani dengan hati-hati karena merupakan bahan korosif.
| Penampilan | Kristal merah tua |
| Berat jenis | 2.70 |
| Warna | Merah |
| Bau | Tidak berbau |
| Masa molar | 118,01 g/mol |
| Kepadatan | 1,201 gram/ml |
| Titik fusi | Terurai pada ~190°C |
| Titik didih | Terurai pada ~250°C |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Larut |
| Kelarutan | Larut dalam air dan pelarut organik seperti etanol, eter |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | -0,64 |
| pH | Sangat asam (pH <1) |
Keamanan dan bahaya asam kromat
Asam kromium menimbulkan beberapa risiko keamanan dan harus ditangani dengan hati-hati. Ini adalah zat korosif yang dapat menyebabkan luka bakar parah pada kulit, mata, dan sistem pernapasan jika bersentuhan. Menghirup uap atau kabut asam kromium dapat mengiritasi saluran pernapasan dan menyebabkan batuk, sesak napas, dan kerusakan paru-paru. Ini juga sangat beracun jika tertelan, menyebabkan sakit perut, muntah, dan potensi kerusakan organ. Selain itu, asam kromium merupakan zat pengoksidasi kuat dan dapat bereaksi keras atau menyulut zat yang mudah terbakar. Peralatan pelindung yang sesuai, seperti sarung tangan, kacamata, dan jas lab, harus dipakai saat bekerja dengan asam kromium, dan harus disimpan serta dibuang sesuai dengan peraturan keselamatan.
| Simbol bahaya | Korosif, Pengoksidasi |
| Deskripsi Keamanan | – Menyebabkan luka bakar parah – Dapat menyebabkan kebakaran hebat; oksidator – Berbahaya jika tertelan – Menyebabkan iritasi saluran pernapasan – Menyebabkan kerusakan mata – Dapat menyebabkan cacat genetik – Dapat menyebabkan kanker – Dapat merusak kesuburan atau janin – Sangat beracun bagi kehidupan akuatik – Tangani dan buang dengan benar |
| Nomor identifikasi PBB | UN1755, UN1463 |
| kode HS | 28191000 |
| Kelas bahaya | 8 (Korosif) |
| Kelompok pengepakan | II (Menengah) |
| Toksisitas | Sangat beracun dan berbahaya |
Metode sintesis asam kromat
Ada beberapa metode untuk mensintesis asam kromium.
Metode yang umum melibatkan reaksi antara natrium dikromat (Na2Cr2O7) dan asam sulfat (H2SO4) . Dalam proses ini, Anda menambahkan natrium dikromat secara perlahan ke dalam asam sulfat sambil diaduk. Reaksi berlanjut untuk membentuk asam kromium (H2CrO4) dan natrium sulfat (Na2SO4) sebagai produk sampingan. Larutan asam kromium yang dihasilkan dapat dimurnikan dan dipekatkan dengan menghilangkan kelebihan air.
Mirip dengan metode sebelumnya, kita dapat menambahkan kalium kromat ke asam sulfat , menghasilkan pembentukan asam kromium dan kalium sulfat (K2SO4) sebagai produk sampingan.
Alternatifnya, Anda dapat membuat asam kromium dengan mereaksikan kromium trioksida (CrO3) dengan air. Anda melarutkan kromium trioksida dalam air, menghasilkan pembentukan larutan asam kromium.
Ingatlah bahwa asam kromium adalah zat yang sangat korosif dan berbahaya. Oleh karena itu, sintesisnya harus dilakukan dengan tindakan pencegahan keselamatan yang tepat dan di area yang berventilasi baik. Kenakan peralatan pelindung, seperti sarung tangan, kacamata, dan jas lab, selama proses sintesis. Ikuti juga metode pembuangan yang benar untuk memastikan penanganan dan pembuangan limbah yang dihasilkan selama sintesis secara aman.
Kegunaan Asam Kromat
Asam kromium banyak digunakan karena sifatnya sebagai oksidator yang kuat. Berikut beberapa kegunaan umum:
- Pembersihan Logam: Asam Kromium secara efektif menghilangkan karat, kerak, dan endapan organik dari permukaan logam, membersihkan dan menghilangkan kontaminan permukaan.
- Pengetsaan: Asam kromium menciptakan pola dan desain halus pada permukaan, seperti kaca, keramik, dan logam, mengetsanya dan membuatnya berguna dalam produksi barang pecah belah dekoratif dan pembuatan sirkuit elektronik.
- Persiapan permukaan: Proses industri menggunakan asam kromat untuk mempersiapkan permukaan untuk pengecatan, pelapisan atau pengikatan, memastikan daya rekat yang baik dengan menghilangkan kotoran dan menciptakan permukaan yang bersih.
- Kimia Analitik: Ahli kimia dan laboratorium menggunakan asam kromium sebagai zat pengoksidasi dalam analisis kimia dan eksperimen laboratorium, menentukan konsentrasi senyawa organik tertentu.
- Pengawetan Kayu: Asam kromium bertindak sebagai pengawet kayu, menembus jauh ke dalam serat kayu untuk melindunginya dari pembusukan, serangan serangga, dan pelapukan.
- Industri Tekstil: Industri tekstil menggunakan asam kromium untuk proses pencelupan dan pencetakan, memperbaiki pewarna pada kain dan meningkatkan tahan luntur warna.
- Fotografi: Asam kromium berperan dalam proses fotografi tertentu, termasuk produksi cetakan berwarna dan film pembalikan warna.
- Elektroplating: Dalam proses pelapisan listrik, khususnya untuk pelapisan krom, asam kromium berfungsi sebagai sumber ion kromium yang disimpan pada permukaan logam, memberikan lapisan pelindung dan dekoratif.
Penting untuk diingat bahwa asam kromium adalah zat berbahaya dan tindakan pencegahan keselamatan yang tepat harus dilakukan saat menangani, menyimpan, dan membuangnya.
Pertanyaan:
Q: Apa yang terjadi jika fenol dioksidasi dengan asam kromat?
A: Fenol mengalami oksidasi dengan asam kromium, menghasilkan pembentukan kuinon dan air.
T: Bagaimana cara menyiapkan asam kromat?
A: Asam kromium dapat dibuat dengan mereaksikan natrium dikromat atau kalium kromat dengan asam sulfat.
Q: Bagaimana cara membuat asam kromat?
A: Asam kromium dapat dibuat dengan mencampurkan senyawa kromium (seperti kromium trioksida) dengan air.
T: Apa itu asam kromat?
A: Asam kromium adalah zat pengoksidasi kuat dan korosif yang terdiri dari kromium, hidrogen, dan oksigen.
Q: Apakah asam kromat mereduksi alkena?
J: Tidak, asam kromium merupakan zat pengoksidasi dan tidak memiliki sifat pereduksi.
T: Bagaimana cara menyiapkan asam kromat untuk membersihkan peralatan gelas laboratorium?
A: Larutan pembersih asam kromium dapat dibuat dengan melarutkan kromium trioksida dalam air dan menambahkan asam sulfat.
Q: Apakah asam kromat termasuk asam kuat?
J: Ya, asam kromium dianggap sebagai asam kuat karena kemampuannya menyumbangkan proton.
T: Bagaimana cara menyiapkan larutan pembersih asam kromat?
A: Untuk membuat larutan pembersih asam kromium, larutkan kromium trioksida dalam air dan tambahkan sedikit asam sulfat.
T: Alkohol manakah di bawah ini yang memberikan hasil tes asam kromat positif?
J: Alkohol primer dapat memberikan tes asam kromium positif, menghasilkan perubahan warna dari oranye menjadi hijau atau biru.
