Etana adalah hidrokarbon dengan rumus kimia C2H6. Ini biasanya digunakan sebagai bahan bakar dan merupakan komponen gas alam. Etana memiliki dua atom karbon dan enam atom hidrogen.
| Nama IUPAC | Etana |
| Formula molekul | C2H6 |
| nomor CAS | 74-84-0 |
| Sinonim | Dietil, dimetil, etil hidrida, metilmetana |
| Di ChI | InChI=1S/C2H6/c1-2/h1-2H3 |
Sifat etana
rumus etana
Rumus kimia etana adalah C2H6. Hal ini menunjukkan bahwa setiap molekul etana terdiri dari dua atom karbon dan enam atom hidrogen. Rumusnya membantu kita memahami komposisi etana dan susunan strukturnya.
Massa Molar Etana
Massa molar etil hidrida dihitung dengan menjumlahkan massa atom unsur penyusunnya. Karbon memiliki massa atom 12,01 g/mol dan hidrogen memiliki massa atom 1,008 g/mol. Mengalikan massa atom dengan jumlah masing-masing dan menjumlahkannya menghasilkan massa molar etil hidrida, yaitu kira-kira 30,07 g/mol.
Titik didih etana
Etil hidrida memiliki titik didih -88,6 derajat Celcius. Artinya pada tekanan atmosfer standar, etil hidrida akan berubah wujud dari cair menjadi gas bila dipanaskan hingga suhu tersebut. Titik didih merupakan sifat penting karena menentukan kondisi di mana etil hidrida dapat menguap.
Titik Leleh Etana
Titik leleh etil hidrida adalah -182,8 derajat Celcius. Pada suhu di bawah titik ini, etil hidrida berbentuk padat. Ketika dipanaskan sampai suhu ini atau lebih, etil hidrida mengalami perubahan fasa dari padat menjadi cair. Titik leleh sangat penting untuk memahami perilaku fisik etil hidrida selama proses pendinginan atau pemanasan.
Kepadatan etana g/mL
Massa jenis etil hidrida kira-kira 0,55 g/mL pada suhu dan tekanan standar. Kepadatan adalah ukuran jumlah massa yang ada dalam volume tertentu. Dalam kasus etil hidrida, ini memberi tahu kita seberapa erat molekul-molekulnya tersusun dan memberikan wawasan tentang sifat fisiknya.
Berat Molekul Etana
Berat molekul etil hidrida adalah 30,07 g/mol. Ini adalah jumlah massa atom semua atom dalam satu molekul etil hidrida. Berat molekul membantu kita menentukan berapa banyak etil hidrida yang ada dalam massa atau volume tertentu.
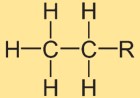
Struktur etana
Struktur etil hidrida terdiri dari dua atom karbon yang dihubungkan oleh ikatan kovalen tunggal. Setiap atom karbon dikelilingi oleh tiga atom hidrogen. Susunan strukturnya linier, dengan atom hidrogen ditempatkan secara simetris di sekitar ikatan karbon-karbon.
Kelarutan etana
Etil hidrida tidak terlalu larut dalam air. Ini adalah molekul nonpolar, sedangkan air adalah pelarut polar. Molekul nonpolar seperti etil hidrida memiliki gaya antarmolekul yang lemah dan tidak mudah larut dalam pelarut polar. Namun, etil hidrida dapat larut dalam pelarut nonpolar lainnya, seperti heksana atau benzena.
| Penampilan | Gas tidak berwarna |
| Berat jenis | 1,038 gram/L |
| Warna | T/A |
| Bau | Tidak berbau |
| Masa molar | 30,07 g/mol |
| Kepadatan | 0,55g/ml |
| Titik fusi | -182,8°C |
| Titik didih | -88,6°C |
| Titik kilat | -135°C |
| Kelarutan dalam air | Tidak larut |
| Kelarutan | Larut dalam pelarut non-polar |
| Tekanan uap | 46,9 psi (pada 21°C) |
| Kepadatan uap | 1,52 (udara = 1) |
| pKa | ~50 |
| pH | T/A |
Keamanan dan Bahaya Etana
Etil hidrida menghadirkan beberapa pertimbangan dan bahaya keamanan. Bahan ini sangat mudah terbakar dan dapat membentuk campuran yang mudah meledak dengan udara. Jika terkena api atau sumber panas, etil hidrida dapat terbakar, menyebabkan kebakaran atau ledakan. Penting untuk menangani dan menyimpan etil hidrida di tempat yang berventilasi baik, jauh dari sumber api. Etil hidrida juga menimbulkan bahaya sesak napas karena menggantikan oksigen di ruang tertutup. Menghirup etil hidrida konsentrasi tinggi dapat menyebabkan pusing, mual, dan bahkan kehilangan kesadaran. Penting untuk menggunakan alat pelindung diri yang sesuai dan mengikuti protokol keselamatan saat bekerja dengan atau di dekat etil hidrida untuk mengurangi risiko ini.
| Simbol bahaya | Gas mudah terbakar |
| Deskripsi Keamanan | Jauhkan dari panas, percikan api, dan nyala api terbuka. Gunakan di area berventilasi baik. Tangani dengan tindakan pencegahan yang tepat untuk menghindari risiko kebakaran atau ledakan. |
| Nomor identifikasi PBB | UN1035 |
| kode HS | 29011000 |
| Kelas bahaya | 2.1 (Gas yang mudah terbakar) |
| Kelompok pengepakan | Tak dapat diterapkan |
| Toksisitas | Etana tidak dianggap sangat beracun. Namun, menghirup konsentrasi tinggi dapat menyebabkan sesak napas. Gunakan dengan ventilasi yang memadai dan hindari paparan yang terlalu lama. |
Metode sintesis etana
Berbagai metode mensintesis etil hidrida.
Metode yang umum adalah proses perengkahan uap, di mana suhu tinggi (sekitar 750 hingga 900 °C) memanaskan hidrokarbon, biasanya etil hidrida atau hidrokarbon yang lebih berat, dengan adanya uap. Proses ini memicu reaksi termasuk dekomposisi dan penataan ulang termal, menghasilkan etil hidrida, etilen, dan propilena.
Metode lain melibatkan hidrogenasi katalitik asetilena , di mana gas asetilena bereaksi dengan hidrogen melalui katalis yang sesuai seperti paladium atau nikel, menghasilkan etil hidrida. Metode ini secara selektif mengubah asetilena yang sangat reaktif dan berpotensi berbahaya menjadi etil hidrida yang lebih stabil dan kurang reaktif.
Etana juga dapat diperoleh dari gas alam melalui ekstraksi kriogenik. Gas alam, terutama metil hidrida, mengalami suhu rendah dan tekanan tinggi untuk memisahkan dan memperoleh kembali etil hidrida. Pabrik pengolahan gas alam biasanya menggunakan proses ini untuk mengekstraksi etil hidrida yang berharga untuk berbagai aplikasi industri.
Selain itu, penyulingan minyak bumi dan beberapa proses petrokimia menghasilkan etil hidrida sebagai produk sampingan. Teknik seperti distilasi atau penyerapan memisahkan etil hidrida dari aliran hidrokarbon lainnya.
Secara keseluruhan, metode sintesis ini memungkinkan produksi etil hidrida, bahan mentah penting untuk pembuatan berbagai macam bahan kimia, plastik, dan bahan bakar, sehingga berkontribusi pada banyak industri di seluruh dunia.
Kegunaan etana
Etil hidrida dapat diterapkan di berbagai industri karena sifatnya yang serbaguna. Berikut beberapa kegunaan utama etil hidrida:
- Industri petrokimia: Etil hidrida merupakan bahan baku penting untuk produksi etilen, yang berfungsi sebagai bahan dasar plastik, resin, dan serat sintetis. Ini adalah elemen kunci dalam pembuatan polietilen, salah satu plastik yang paling banyak digunakan di dunia.
- Bahan Bakar dan Energi: Etil hidrida berperan dalam bahan bakar dan menggerakkan proses industri tertentu dan merupakan konstituen gas alam. Industri membakar etil hidrida untuk menghasilkan panas atau listrik, yang berfungsi sebagai sumber energi untuk aplikasi perumahan, komersial, dan industri.
- Pendinginan: Dalam beberapa aplikasi, seperti sistem suhu rendah, etil hidrida berfungsi sebagai zat pendingin, memberikan kemampuan pendinginan yang efisien. Ini menawarkan kemampuan pendinginan yang efisien dan merupakan alternatif terhadap zat pendingin lain dengan dampak lingkungan yang lebih tinggi.
- Pelarut: Etil hidrida berfungsi sebagai pelarut nonpolar, terutama di laboratorium. Etil hidrida memfasilitasi proses seperti ekstraksi, pemurnian dan analisis.
- Gas kalibrasi: Etil hidrida berfungsi sebagai komponen dalam kalibrasi campuran gas untuk detektor dan penganalisis gas, memungkinkan kalibrasi dan verifikasi peralatan deteksi gas.
- Propelan Aerosol: Etil hidrida berfungsi sebagai propelan aerosol dalam berbagai produk, mengeluarkan isinya dari wadah setelah tekanan dilepaskan. Ini memberikan kekuatan yang dibutuhkan untuk menyemprotkan zat seperti kosmetik, cat dan produk rumah tangga.
- Sintesis kimia: Etil hidrida berfungsi sebagai bahan mentah untuk sintesis berbagai bahan kimia organik, termasuk etanol, etilen oksida, dan vinil klorida. Bahan kimia ini dapat diterapkan antara lain dalam produksi pelarut, plastik, deterjen, dan pipa PVC.
Penerapan yang beragam ini menyoroti pentingnya etil hidrida di berbagai industri, menjadikannya elemen penting dalam manufaktur modern dan kehidupan sehari-hari.
Pertanyaan:
T: Apakah C2H6 polar atau non-polar?
A: C2H6 (etil hidrida) merupakan molekul non-polar karena perbedaan keelektronegatifan antara karbon dan hidrogen kecil, sehingga menghasilkan distribusi kerapatan elektron yang seragam.
Q: Berapa mol atom karbon yang terdapat dalam 0,500 mol C2H6?
A: Dalam 0,500 mol C2H6 terdapat 1,00 mol atom karbon karena setiap molekul C2H6 mengandung 2 atom karbon.
Q: Apa rumus empiris C2H6?
J: Rumus empiris C2H6 adalah CH3, yang mewakili rasio paling sederhana dari atom-atom yang ada dalam molekul.
T: Apa itu C2H6?
A: C2H6 adalah rumus kimia etil hidrida, suatu gas hidrokarbon yang biasa digunakan sebagai bahan bakar dan komponen gas alam.
Q: Mengapa etana (C2H6) tidak memiliki isomer struktural?
A: Etil hidrida (C2H6) tidak memiliki isomer struktural karena atom karbonnya disatukan melalui ikatan tunggal, sehingga menghasilkan struktur linier tanpa kemungkinan susunan lain.
Q: Apakah C2H6 memiliki ikatan hidrogen?
J: C2H6 (etil hidrida) tidak memiliki ikatan hidrogen karena tidak memiliki atom hidrogen yang terikat pada unsur yang sangat elektronegatif seperti nitrogen, oksigen, atau fluor.
Q: Apakah C2H6 bersifat ionik atau kovalen?
J: C2H6 merupakan senyawa kovalen karena terbentuk melalui pembagian elektron antara atom karbon dan hidrogen.
Q: Apakah C2H6 larut dalam air?
A: C2H6 tidak larut dalam air karena merupakan molekul non-polar dan tidak mudah larut dalam pelarut polar.
Q: Apakah campuran gas mengandung CH4 dan C2H6 dengan perbandingan molar sama?
A: Ya, jika campuran gas mengandung CH4 dan C2H6 dengan perbandingan ekuimolar, berarti jumlah mol CH4 sama dengan jumlah mol C2H6 dalam campuran tersebut.
