Asam kloroasetat adalah senyawa kimia dengan rumus CH₂ClCOOH. Ini digunakan dalam berbagai aplikasi industri, termasuk produksi pewarna, obat-obatan dan herbisida.
| Nama IUPAC | Asam kloroasetat |
| Formula molekul | CH₂ClCOOH |
| nomor CAS | 79-11-8 |
| Sinonim | Asam monokloroasetat, MCA, asam kloroetanoat, asam kloroetil |
| Di ChI | InChI=1S/C2H3ClO2/c3-1-2(4)5/h1H2,(H,4.5) |
Sifat asam kloroasetat
Formula Asam Kloroasetat
Rumus asam kloroasetat adalah CH₂ClCOOH. Ini terdiri dari dua atom karbon, tiga atom hidrogen, satu atom klor dan dua atom oksigen. Atom klor terikat pada salah satu atom karbon, sedangkan atom karbon lainnya terikat pada gugus asam karboksilat (-COOH).
Massa Molar Asam Kloroasetat
Massa molar asam monokloroasetat dihitung dengan menjumlahkan massa atom unsur penyusunnya. Asam monokloroasetat memiliki massa molar sekitar 94,5 gram per mol. Hal ini ditentukan dengan mempertimbangkan massa atom karbon (C), hidrogen (H), klor (Cl) dan oksigen (O) yang ada dalam senyawa.
Titik didih asam kloroasetat
Asam monokloroasetat memiliki titik didih sekitar 189 derajat Celcius. Pada suhu ini, asam monokloroasetat cair berubah menjadi fase gas. Titik didih asam monokloroasetat dipengaruhi oleh gaya antarmolekul antara molekulnya dan tekanan atmosfer.
Titik lebur asam kloroasetat
Titik leleh asam monokloroasetat sekitar 62 derajat Celcius. Ini adalah suhu di mana bentuk padat asam monokloroasetat berubah menjadi cair. Titik leleh mungkin sedikit berbeda tergantung pada kemurnian sampel dan kondisi pengukurannya.
Massa jenis asam kloroasetat g/mL
Massa jenis asam monokloroasetat kira-kira 1,58 gram per mililiter. Ini menunjukkan massa asam monokloroasetat per satuan volume. Kepadatan asam monokloroasetat dipengaruhi oleh faktor-faktor seperti suhu dan tekanan.
Berat Molekul Asam Kloroasetat
Berat molekul asam monokloroasetat kira-kira 94,5 gram per mol. Ini mewakili jumlah berat atom semua atom dalam molekul asam monokloroasetat. Berat molekul berguna dalam berbagai perhitungan yang melibatkan senyawa, seperti menentukan konsentrasi atau kuantitas molar.
Struktur asam kloroasetat
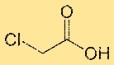
Asam monokloroasetat memiliki struktur yang terdiri dari atom karbon pusat yang terikat pada atom klor, gugus asam karboksilat (-COOH), dan dua atom hidrogen. Atom klor terikat langsung pada atom karbon. Susunan struktur asam monokloroasetat mempengaruhi sifat kimia dan reaktivitasnya.
Kelarutan asam kloroasetat
Asam monokloroasetat cukup larut dalam air. Ini membentuk ikatan hidrogen dengan molekul air, memungkinkannya larut sampai batas tertentu. Kelarutan asam monokloroasetat dipengaruhi oleh faktor-faktor seperti suhu, pH dan keberadaan zat lain dalam larutan.
| Penampilan | Cairan tidak berwarna |
| Berat jenis | 1,58g/ml |
| Warna | Tanpa warna |
| Bau | Cuka |
| Masa molar | 94,5 g/mol |
| Kepadatan | 1,58g/ml |
| Titik fusi | 62°C |
| Titik didih | 189°C |
| Titik kilat | 111°C |
| Kelarutan dalam air | Dapat bercampur |
| Kelarutan | Larut dalam etanol, eter, kloroform |
| Tekanan uap | 0,23 mmHg pada 25°C |
| Kepadatan uap | 3.3 (udara = 1) |
| pKa | 2.87 |
| pH | 1,5 – 2,5 |
Keamanan dan bahaya asam kloroasetat
Asam monokloroasetat menimbulkan beberapa risiko keamanan dan harus ditangani dengan hati-hati. Ini bersifat korosif terhadap kulit, mata dan sistem pernapasan, menyebabkan luka bakar dan iritasi. Kontak langsung dapat menyebabkan kerusakan serius pada kulit dan mata. Menghirup uap atau kabutnya dapat mengiritasi saluran pernapasan. Hal ini juga berbahaya jika tertelan, menyebabkan gangguan pencernaan. Peralatan pelindung diri yang sesuai, seperti sarung tangan dan kacamata, harus dipakai saat bekerja dengan asam monokloroasetat. Ventilasi yang memadai sangat penting untuk meminimalkan paparan. Jika terjadi kontak dengan kulit atau mata, segera bilas dengan air sangat penting dan perhatian medis harus dicari.
| Simbol bahaya | Korosif, Beracun |
| Deskripsi Keamanan | Hindari kontak. Gunakan alat pelindung diri. Pastikan ventilasi yang memadai. Tangani dengan hati-hati. |
| Nomor identifikasi PBB | PBB 1751 |
| kode HS | 2915.12.00 |
| Kelas bahaya | 8 (Korosif) |
| Kelompok pengepakan | II |
| Toksisitas | Beracun jika tertelan, terhirup, dan terserap oleh kulit. Menyebabkan luka bakar parah dan kerusakan mata. Berbahaya jika tertelan. |
Metode sintesis asam kloroasetat
Berbagai metode memungkinkan sintesis asam monokloroasetat.
Metode yang umum digunakan untuk mensintesis asam monokloroasetat melibatkan perlakuan asam asetat dengan zat penghalogenasi, biasanya gas klor (Cl₂), dengan adanya katalis seperti asam sulfat (H₂SO₄). Reaksi antara asam asetat dan klor mengakibatkan substitusi atom hidrogen dalam molekul asam asetat dengan atom klor, sehingga membentuk asam monokloroasetat.
Metode lain melibatkan reaksi antara asetil klorida (CH₃COCl) dan air (H₂O). Air menghidrolisis asetil klorida, menghasilkan pembentukan asam monokloroasetat. Reaksi ini bersifat eksotermik dan memerlukan kehati-hatian saat melakukannya.
Pembentukan asam monokloroasetat terjadi melalui karboksilasi klorometana (CH₃Cl) menggunakan karbon dioksida (CO₂) dengan adanya basa kuat seperti natrium hidroksida (NaOH) . Reaksi berlangsung melalui substitusi nukleofilik, di mana gugus karboksilat (-COOH) dari molekul karbon dioksida menggantikan ion klorida.
Ingatlah bahwa penanganan yang tepat dan tindakan pencegahan keselamatan sangat penting untuk metode sintesis ini karena sifat asam monokloroasetat yang korosif dan beracun. Pastikan kontrol yang cermat terhadap kondisi reaksi dan pembuangan produk sampingan dan limbah dengan benar untuk memastikan proses sintesis yang aman dan efisien.
Kegunaan Asam Kloroasetat
Asam monokloroasetat dapat diterapkan di berbagai industri karena sifatnya yang serbaguna. Berikut beberapa kegunaan umum:
- Produksi herbisida: Asam monokloroasetat merupakan bahan penting dalam sintesis herbisida, seperti glifosat. Ini membantu menghambat pertumbuhan tanaman dan gulma yang tidak diinginkan di pertanian.
- Manufaktur Farmasi: Ini berfungsi sebagai bahan penyusun dalam produksi senyawa farmasi, termasuk antibiotik, antiseptik, dan analgesik. Asam monokloroasetat membantu memodifikasi dan meningkatkan sifat yang diinginkan dari obat ini.
- Industri Pewarna dan Pigmen: Produsen menggunakan asam monokloroasetat dalam produksi pewarna dan pigmen. Ini membantu dalam sintesis pewarna yang digunakan dalam tekstil, cat, tinta dan aplikasi dekoratif lainnya.
- Bahan Antara Kimia: Bertindak sebagai senyawa perantara utama dalam produksi berbagai bahan kimia. Sintesis polimer, pelarut, pemlastis dan senyawa organik lainnya melibatkan penggunaan zat antara ini.
- Pembuatan Surfaktan: Asam monokloroasetat berperan dalam produksi surfaktan, yang merupakan komponen penting dari deterjen, bahan pembersih, dan produk perawatan pribadi. Surfaktan membantu mengurangi tegangan permukaan antar cairan, memungkinkan kemampuan pencampuran dan pendispersian yang lebih baik.
- Aplikasi Penelitian dan Laboratorium: Laboratorium penelitian menggunakan asam monokloroasetat sebagai reagen untuk reaksi kimia, khususnya dalam sintesis organik dan prosedur analitik.
- Reaksi Kimia dan Sintesis Organik: Ini berfungsi sebagai reagen penting dalam berbagai reaksi organik, seperti substitusi nukleofilik, esterifikasi, dan reaksi karboksilasi.
- Pelapisan listrik: Asam monokloroasetat dapat diterapkan dalam proses pelapisan listrik, yang bertindak sebagai sumber klorin untuk pengendapan lapisan logam pada permukaan.
Aplikasi yang beragam ini menyoroti pentingnya asam monokloroasetat di semua industri, berkontribusi terhadap pengembangan berbagai produk dan proses kimia.
Pertanyaan:
Q: Berapa nilai Ka untuk larutan asam kloroasetat 0,15 M dengan pH 1,86?
A: Nilai Ka asam monokloroasetat dapat dihitung dengan menggunakan nilai pH kira-kira 1,4 x 10^-3.
Q: Apakah asam kloroasetat kuat atau lemah?
Jawaban: Asam monokloroasetat merupakan asam lemah.
T: Apa yang diberikan oleh natrium 4-klorofenolat + asam kloroasetat?
A: Reaksi natrium 4-klorofenolat dengan asam monokloroasetat menghasilkan asam 4-klorofenoksiasetat dan natrium klorida.
T: Berapa Ka asam kloroasetat?
A: Nilai Ka asam monokloroasetat kira-kira 1,4 x 10^-3.
T: Apakah asam kloroasetat bersifat monoprotik?
J: Ya, asam monokloroasetat bersifat monoprotik, artinya hanya dapat melepaskan satu proton (ion H+) dalam suatu reaksi kimia.
Q: Berapa konstanta ionisasi asam kloroasetat?
A: Konstanta ionisasi (Ka) asam monokloroasetat kira-kira 1,4 x 10^-3.
Q: Apakah asam kloroasetat lebih kuat dari asam asetat?
A: Ya, asam monokloroasetat lebih kuat dari asam asetat.
Q: Mengapa asam kloroasetat lebih kuat dari asam asetat?
J: Kehadiran atom klor dalam asam monokloroasetat meningkatkan kapasitas penarikan elektron, menjadikannya lebih asam daripada asam asetat.
Q: Berapa massa molar asam kloroasetat?
J: Massa molar asam monokloroasetat kira-kira 94,5 gram per mol.
