EDTA adalah asam amino polikarboksilat yang dapat mengkelat ion logam. Ia memiliki rumus [CH2N(CH2CO2H)2]2. Ini membantu menghilangkan logam berat dari tubuh. EDTA juga mengawetkan sampel darah dan produk makanan.
| Nama keluarga Iupac | 2,2′,2″,2″‘-(etana-1,2-diildiammonia)disodium tetraasetat |
| Formula molekul | C10H14N2Na2O8 |
| nomor CAS | 139-33-3 |
| Sinonim | Garam dinatrium dari asam (etilenedinitrilo)tetraasetat, dinatrium edetat, dinatrium EDTA, dinatrium edetat, dinatrium EDTA, garam dinatrium dari EDTA, garam dinatrium dari etilenbis (asam iminodiasetat), N,N’-1,2- etanediylbis [N-(karboksimetil) )glisin], garam dinatrium, Na2-EDTA, Na2H2EDTA |
| inci | InChI=1S/C10H16N2O8.2Na/c13-7(14)3-11(4-8(15)16)1-2-12(5-9(17)18)6-10(19)20;;/ h1-6H2,(H,13,14)(H,15,16)(H,17,18)(H,19,20);;/q;2*+1/p-2 |
Properti EDTA
rumus EDTA
EDTA adalah singkatan dari ethylenediaminetetraacetic acid, yaitu senyawa organik sintetik yang mampu mengkelat ion logam. Rumus EDTA adalah C10H16N2O8 yang artinya mengandung 10 atom karbon, 16 atom hidrogen, 2 atom nitrogen, dan 8 atom oksigen dalam molekulnya.
Massa Molar EDTA
Massa molar dinatrium edetat adalah jumlah massa atom seluruh atom dalam rumusnya. Massa atom karbon, hidrogen, nitrogen, dan oksigen masing-masing adalah 12,01 g/mol, 1,01 g/mol, 14,01 g/mol, dan 16,00 g/mol. . Jadi, massa molar dinatrium edetat adalah (10 x 12,01) + (16 x 1,01) + (2 x 14,01) + (8 x 16,00) = 292,24 g/mol.
Titik didih EDTA
Titik didih suatu zat adalah suhu saat zat berubah wujud dari cair menjadi gas. Titik didih dinatrium edetat tidak mudah diukur karena terurai sebelum mencapai titik didihnya. Namun, beberapa sumber memperkirakan titik didih dinatrium edetat kira-kira 614,2 °C pada tekanan 760 mmHg.
EDTA Titik lebur
Titik leleh suatu zat adalah suhu perubahan wujud padat menjadi cair. Titik leleh dinatrium edetat bergantung pada derajat hidrasi dan kristalisasi. Bentuk dinatrium edetat anhidrat memiliki titik leleh sekitar 240°C, sedangkan bentuk dihidrat memiliki titik leleh sekitar 248°C.
Kepadatan EDTA g/ml
Massa jenis suatu zat adalah massa per satuan volume. Kepadatan dinatrium edetat juga bervariasi tergantung pada derajat hidrasi dan kristalisasi. Bentuk dinatrium edetat anhidrat memiliki kepadatan sekitar 0,86 g/ml, sedangkan bentuk dihidrat memiliki kepadatan sekitar 1,6 g/ml.
Berat Molekul EDTA
Berat molekul suatu zat adalah istilah lain dari massa molarnya, yaitu massa satu mol zat tersebut. Seperti disebutkan di atas, massa molar dinatrium edetat adalah 292,24 g/mol, sehingga berat molekulnya juga 292,24 g/mol.
Struktur EDTA
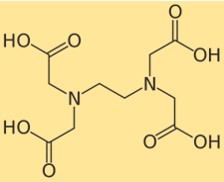
Struktur dinatrium edetat menunjukkan bagaimana atom-atomnya tersusun dan terikat dalam molekulnya. Dinatrium edetat mempunyai gugus etilendiamin sentral dengan empat gugus asam karboksilat terikat. Setiap gugus asam karboksilat dapat kehilangan satu proton dan membentuk muatan negatif, yang dapat berikatan dengan ion logam. Struktur dinatrium edetat dapat digambarkan dengan diagram berikut:
Kelarutan EDTA
Kelarutan suatu zat adalah jumlah zat yang dapat larut dalam suatu pelarut tertentu pada suhu dan tekanan tertentu. Kelarutan dinatrium edetat bergantung pada pH dan keberadaan ion logam dalam larutan. Dinatrium edemat lebih larut dalam larutan basa dibandingkan larutan asam karena lebih banyak membentuk muatan negatif yang dapat berinteraksi dengan molekul air. Dinatrium edetat juga dapat membentuk kompleks dengan ion logam, yang dapat meningkatkan atau menurunkan kelarutannya tergantung pada stabilitas dan muatan kompleks. Misalnya, pada pH 7 dan 25 °C, kelarutan dinatrium edetat dalam air kira-kira 0,5 M (186 mg/mL), sedangkan kelarutan kompleks kalsiumnya kira-kira 0,02 M (7 mg/ml).
| Penampilan | Padatan kristal putih |
| Kepadatan spesifik | Tidak tersedia |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 292,24 g/mol |
| Kepadatan | 1,6 g/ml (dihidrat), 0,86 g/ml (anhidrat) |
| Titik fusi | 248°C (dihidrat), 240°C (anhidrat) |
| Titik didih | 614.2°C (terurai) |
| Titik kilat | 325,2°C |
| Kelarutan dalam air | 0,5 M (186 mg/ml) pada pH 7 dan 25 °C |
| Kelarutan | Larut dalam larutan basa, tidak larut dalam pelarut organik |
| Tekanan uap | 3,77 x 10^-12 mmHg pada 25°C |
| Kepadatan uap | Tidak tersedia |
| pKa | 2.0, 2.7, 6.2, 10.3 |
| pH | 4 hingga 6 (larutan 0,26 M) |
Risiko Keamanan EDTA
Disodium edetat merupakan senyawa organik sintetik yang dapat mengkelat ion logam. Penerapannya beragam di bidang kedokteran, industri, pertanian dan penelitian. Namun, hal ini juga menimbulkan risiko tertentu terhadap kesehatan manusia dan lingkungan jika tidak ditangani dengan benar.
Disodium Edetate dapat mengiritasi kulit dan mata jika terkena. Ini juga dapat menyebabkan mual, muntah, diare dan sakit perut jika tertelan. Ini dapat membahayakan sistem pernapasan jika terhirup. Ini dapat mempengaruhi sel darah dan ginjal jika diserap ke dalam tubuh. Ini bisa berakibat fatal dalam dosis besar.
Disodium edetat juga dapat mencemari tanah dan air jika dilepaskan ke lingkungan. Ini dapat mengikat logam esensial dan mempengaruhi ketersediaannya bagi tanaman dan hewan. Hal ini dapat mengganggu proses biologis yang bergantung pada ion logam.
Gunakan disodium edetat dengan hati-hati dan dengan peralatan pelindung yang sesuai. Simpan di tempat sejuk, kering, dan berventilasi baik. Buang sesuai dengan peraturan setempat.
| Simbol bahaya | |
| Deskripsi Keamanan | S24/25: Hindari kontak dengan kulit dan mata |
| Nomor identifikasi PBB | UN3077 (padat), UN3082 (cair) |
| kode HS | 29224985 |
| Kelas bahaya | 9 (berbagai bahan berbahaya) |
| Kelompok pengepakan | III (bahaya rendah) |
| Toksisitas | Tikus LD50 oral: 2000 mg/kg |
Metode Sintesis EDTA
Ada beberapa metode untuk mensintesis dinatrium edetat, tetapi yang paling umum adalah kondensasi etilendiamin dengan asam kloroasetat atau garam natriumnya.
Reaksi ini melibatkan dua langkah: pertama, serangan nukleofilik etilendiamin pada asam kloroasetat atau garam natriumnya membentuk zat antara monoamida. Kedua, penghilangan asam klorida atau natrium klorida membentuk gugus asam karboksilat. Untuk membentuk dinatrium edetat, dapat direaksikan dengan asam kloroasetat lain yang setara atau garam natriumnya.
Metode lain untuk mensintesis dinatrium edetat adalah oksidasi etilendiamin dengan natrium hipoklorit dalam larutan basa. Metode ini menghasilkan dinatrium edetat sebagai garam natrium dan amonia sebagai produk sampingan.
Metode lain untuk mensintesis dinatrium edetat termasuk mereaksikan etilendiamin dengan formaldehida dan natrium sianida atau mereaksikan etilendiamin dengan asam glioksilat atau esternya.
Kegunaan EDTA
Disodium edetat merupakan senyawa organik sintetik yang dapat mengkelat ion logam. Ini memiliki berbagai kegunaan di berbagai bidang dan industri. Beberapa kegunaan Edetate Disodium adalah:
- Dalam dunia kedokteran, dinatrium edetat dapat mengobati keracunan logam berat dengan cara mengikat logam beracun dan mengeluarkannya dari tubuh. Ini juga dapat mencegah pembekuan darah dan pengapuran arteri dengan mengkelat ion kalsium.
- Pada makanan dan minuman, disodium edetat dapat menjaga warna, rasa dan tekstur produk dengan mencegah oksidasi dan ketengikan. Hal ini juga dapat mencegah perubahan warna dan kerusakan yang disebabkan oleh ion logam.
- Dalam kosmetik dan perawatan pribadi, edetate disodium dapat meningkatkan stabilitas dan efektivitas produk dengan mencegah pertumbuhan mikroba dan reaksi yang dikatalisis logam. Hal ini juga dapat meningkatkan tampilan dan nuansa produk dengan mengkelat mineral yang menyebabkan kesadahan air.
- Dalam industri dan penelitian, dinatrium edetat dapat meningkatkan kinerja dan kualitas produk dan proses dengan mengkelat ion logam yang mengganggu. Misalnya, dapat mencegah pembentukan kerak pada ketel dan pipa, meningkatkan pencelupan dan pencetakan tekstil, menghilangkan karat dan noda pada logam, serta mengontrol pH dan konsentrasi logam dalam metode analisis.
Pertanyaan:
T: Apa itu EDTA?
A: Disodium edetat merupakan senyawa organik sintetik yang dapat mengkelat ion logam. Itu singkatan dari asam etilendiamintetraasetat.
T: Bagaimana cara menyiapkan solusi EDTA?
A: Untuk menyiapkan larutan dinatrium edetat, timbang jumlah dinatrium edetat yang diinginkan dan larutkan dalam air suling. Sesuaikan pH menjadi 8,0 dengan natrium hidroksida.
Q: Bagaimana cara melarutkan EDTA dalam air?
A: Dinatrium edetat larut dalam air, tetapi larut perlahan. Untuk melarutkan dinatrium edetat dalam air, panaskan air hingga suhu kurang lebih 80°C dan aduk campuran hingga dinatrium edetat larut sempurna.
T: Bagaimana cara menyiapkan EDTA 0,5 juta?
A: Untuk membuat dinatrium edetat 0,5M, timbang 73,06 g dinatrium edetat dan larutkan dalam 800 ml air suling. Sesuaikan pH menjadi 8,0 dengan natrium hidroksida dan encerkan larutan hingga 1 L dengan air suling.
T: Apa yang dilakukan EDTA?
A: Dinatrium edetat berikatan dengan ion logam dan membentuk kompleks yang stabil dengannya. Hal ini mencegah ion logam bereaksi dengan zat lain atau mengganggu metode analisis.
T: Apa yang dimaksud dengan EDTA?
A: Disodium edetate artinya asam etilendiamintetraasetat, yaitu nama senyawa dengan rumus [CH2N(CH2CO2H)2]2.
Q: Bagaimana cara menghitung kesadahan air dengan titrasi EDTA?
J: Untuk menghitung kesadahan air dengan titrasi dinatrium edetat, titrasi sampel air dengan volume yang diketahui dengan larutan dinatrium edetat standar menggunakan indikator yang sesuai. Catat volume dinatrium edetat yang digunakan dan gunakan rumus berikut: Kesadahan (mg/L sebagai CaCO3) = (Volume EDTA x Molaritas EDTA x 1000) / Volume sampel air
