Amonium sulfat ((NH4)2SO4) adalah pupuk yang banyak digunakan untuk menyediakan nutrisi penting bagi tanaman. Ini juga digunakan dalam penghambat api, dalam pemurnian protein dan sebagai bahan tambahan makanan.
| Nama IUPAC | Amonium tetraoksosulfat (VI) |
| Formula molekul | (NH4)2SO4 |
| nomor CAS | 7783-20-2 |
| Sinonim | Amonium sulfat, amonium sulfat (2:1), diammonium sulfat, garam diammonium dari asam sulfat, mascagnite, Actamaster, Dolamin |
| Di ChI | InChI=1S/2H3N.H2O4S/c;;1-5(2,3)4/h2*1H3;(H2,1,2,3,4) |
Sifat amonium sulfat
Rumus amonium sulfat
Rumus amonium sulfat adalah (NH4)2SO4. Artinya satu molekul amonium sulfat mengandung dua ion amonium (NH4)+ dan satu ion sulfat (SO4)2-. Ion amonium dan ion sulfat disatukan oleh ikatan ionik.
Massa Molar Amonium Sulfat
Massa molar (NH4)2SO4 adalah 132,14 g/mol. Untuk menghitung massa molar, kita perlu menjumlahkan massa atom semua atom dalam rumus. Massa atom adalah:
- Nitrogen: 14,01 g/mol
- Hidrogen: 1,01 g/mol
- Belerang: 32,06 g/mol
- Oksigen: 16,00 g/mol
Jadi, massa molar (NH4)2SO4 adalah:
(2 x 14,01) + (8 x 1,01) + 32,06 + (4 x 16,00) = 132,14 g/mol
Titik didih amonium sulfat
Titik didih (NH4)2SO4 tidak dapat ditentukan dengan jelas karena terurai sebelum mencapai titik didih. Ketika dipanaskan di atas 235°C, (NH4)2SO4 mulai kehilangan air dan membentuk amonium bisulfat (NH4)HSO4. Ketika dipanaskan di atas 280°C, amonium bisulfat selanjutnya terurai menjadi amonia (NH3) dan asam sulfat (H2SO4).
Titik lebur amonium sulfat
Titik leleh (NH4)2SO4 adalah 235°C. Ini adalah suhu di mana (NH4)2SO4 berubah dari padat menjadi cair. Namun seperti disebutkan di atas, (NH4)2SO4 juga mulai terurai pada suhu ini, sehingga bukan fase cair murni.
Massa jenis amonium sulfat g/ml
Massa jenis (NH4)2SO4 adalah 1,77 g/ml pada suhu dan tekanan kamar. Artinya satu mililiter (NH4)2SO4 beratnya 1,77 gram. Massa jenis suatu zat bergantung pada suhu dan tekanannya, sehingga dapat sedikit berbeda pada kondisi yang berbeda.
Berat Molekul Amonium Sulfat
Berat molekul (NH4)2SO4 sama dengan massa molarnya, yaitu 132,14 g/mol. Berat molekul adalah massa satu mol suatu zat, yang setara dengan 6,022 x 10^23 molekul. Berat molekul juga dapat dinyatakan dalam satuan massa atom (sma), yang setara dengan 1/12 massa atom karbon-12. Dalam sma, berat molekul (NH4)2SO4 adalah 132,14 sma.
Struktur amonium sulfat
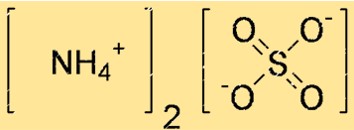
Struktur (NH4)2SO4 dapat direpresentasikan dengan struktur titik Lewis atau model bola-dan-tongkat. Struktur titik Lewis menunjukkan elektron valensi setiap atom dan ikatan di antara mereka. Model bola-dan-tongkat menunjukkan bentuk dan ukuran setiap atom serta ikatan di antara keduanya.
Pada struktur di atas, garis rangkap (=) melambangkan ikatan rangkap, garis tunggal (-) melambangkan ikatan tunggal, dan titik (.) melambangkan pasangan elektron bebas.
Kelarutan amonium sulfat
Kelarutan (NH4)2SO4 adalah banyaknya (NH4)2SO4 yang dapat larut dalam sejumlah air pada suhu tertentu. Kelarutan (NH4)2SO4 meningkat seiring dengan meningkatnya suhu, seperti terlihat pada data berikut:
| Suhu (°C) | Kelarutan (g/100 ml air) |
| 0 | 70.6 |
| Penampilan | Butiran atau kristal higroskopis putih halus |
| Kepadatan spesifik | 1.77 |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 132,14 g/mol |
| Kepadatan | 1,77 gram/cm3 |
| Titik fusi | 235 hingga 280°C (terurai) |
| Titik didih | Tidak berlaku (terurai) |
| Titik kilat | Tidak mudah terbakar |
| Kelarutan dalam air | 70,6 g per 100 g air (0°C), 74,4 g per 100 g air (20°C), 103,8 g per 100 g air (100°C) |
| Kelarutan | Tidak larut dalam aseton, alkohol dan eter |
| Tekanan uap | Dapat diabaikan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | 5.5 (untuk ion amonium) |
| pH | 5 hingga 6 (untuk solusi 5%) |
Keamanan dan bahaya amonium sulfat
(NH4)2SO4 tidak terlalu berbahaya bagi kesehatan manusia, namun dapat menyebabkan iritasi pada kulit, mata, hidung dan tenggorokan jika terkena atau terhirup. Ini juga dapat menyebabkan mual, sakit perut, diare, muntah, dan kantuk jika tertelan. Ini berbahaya bagi kehidupan akuatik dan pelepasannya ke lingkungan harus dihindari. Ia terurai ketika dipanaskan di atas 235°C, membentuk gas beracun seperti amonia dan asam sulfat. Umumnya dianggap aman sebagai bahan tambahan makanan, namun dapat menyebabkan reaksi alergi atau gejala asma pada beberapa orang.
| Simbol bahaya | Tidak perlu |
| Deskripsi Keamanan | Hindari pelepasan ke lingkungan. Buang isi/wadah ke fasilitas pembuangan limbah yang disetujui. |
| Nomor identifikasi PBB | Tak dapat diterapkan |
| kode HS | 31022100 |
| Kelas bahaya | Tak dapat diterapkan |
| Kelompok pengepakan | Tak dapat diterapkan |
| Toksisitas | LD50 (oral, tikus) = 2,840 mg/kg |
Metode sintesis amonium sulfat
(NH4)2SO4 dapat disintesis dengan berbagai metode karena merupakan garam anorganik. Beberapa metode yang umum adalah:
- Netralisasi amonia dan asam sulfat: Metode ini melibatkan pencampuran gas amonia atau larutan berair dengan asam sulfat dan menguapkan air untuk memperoleh kristal (NH4)2SO4.
2NH3 + H2SO4 -> (NH4)2SO4
- Reaksi amonium karbonat dan gipsum: Metode ini melibatkan penambahan gipsum ( kalsium sulfat ) yang telah dipecah halus ke dalam larutan amonium karbonat dan menyaring endapan kalsium karbonat.
(NH4)2CO3 + CaSO4 -> (NH4)2SO4 + CaCO3
- Produk sampingan dari proses lainnya: Berbagai proses industri, seperti pemurnian gas oven kokas, produksi kaprolaktam, pemurnian nikel, dan desulfurisasi gas buang, dapat menghasilkan (NH4)2SO4 sebagai produk sampingan. Proses ini menggunakan senyawa amonia atau amonium untuk menghilangkan belerang atau kotoran lainnya dari aliran gas, sehingga menghasilkan (NH4)2SO4 sebagai limbah atau produk berharga.
Kegunaan amonium sulfat
(NH4)2SO4 merupakan garam anorganik yang mempunyai berbagai kegunaan, seperti:
- Pupuk Tanah Basa: (NH4)2SO4 menurunkan pH tanah dan menyediakan nitrogen dan sulfur untuk pertumbuhan tanaman. Sangat cocok untuk tanaman yang membutuhkan tanah masam, seperti blueberry, kentang, dan tomat.
- Bahan pembantu semprotan pertanian: (NH4)2SO4 meningkatkan efektivitas insektisida, herbisida, dan fungisida yang larut dalam air dengan mengikat ion besi dan kalsium yang dapat mengganggu kerjanya. Hal ini juga meningkatkan penyerapan glifosat dan herbisida sistemik lainnya oleh tanaman.
- Pemurnian protein: (NH4)2SO4 dapat mengendapkan protein dari larutan air dengan meningkatkan kekuatan ionik dan mengurangi kelarutan protein. Metode salting-out dapat digunakan untuk memisahkan protein berdasarkan ukuran, muatan, dan hidrofobisitasnya.
- Bahan Tambahan Makanan: Berbagai produk makanan seperti roti, keju, anggur dan sayuran kaleng menggunakan (NH4)2SO4 sebagai pengatur keasaman, kondisioner adonan, nutrisi ragi dan bahan pengencang. FDA mengakuinya secara umum aman.
- Kegunaan Lain: (NH4)2SO4 dapat digunakan untuk membuat garam amonium lainnya, alat pemadam api, penghambat api, penyamakan kulit, pewarnaan tekstil, pelapisan logam dan kimia analitik.
Pertanyaan:
Q: Apa rumus kimia amonium sulfat?
A: Rumus kimia amonium sulfat adalah (NH4)2SO4. Artinya satu molekul amonium sulfat mengandung dua ion amonium (NH4)+ dan satu ion sulfat (SO4)2-.
T: Apakah amonium sulfat larut?
A: (NH4)2SO4 larut dalam air, tetapi tidak larut dalam aseton, alkohol, dan eter. Dapat melarutkan 70,6 gram per 100 gram air pada 0°C, 74,4 gram per 100 gram air pada 20°C, dan 103,8 gram per 100 gram air pada 100°C.
Q: Berapa banyak amonium sulfat per galon air?
A: Jumlah (NH4)2SO4 per galon air bergantung pada konsentrasi yang diinginkan dan suhu air. Misalnya, jika konsentrasi yang diinginkan adalah 10% (b/v) dan suhu air 20°C, maka jumlah (NH4)2SO4 per galon air adalah:
10% (b/v) = 10 gram per 100 ml air 1 galon = 3785,41 ml 10 gram x 3785,41 ml / 100 ml = 378,54 gram Jadi, banyaknya (NH4)2SO4 per galon air adalah 378,54 gram.
Q: Apakah reaksi terjadi ketika larutan amonium sulfat dan kalsium klorida digabungkan?
J: Tidak, tidak ada reaksi yang terjadi jika larutan encer (NH4)2SO4 dan kalsium klorida digabungkan. Memang benar, kedua garam tersebut larut dalam air dan tidak membentuk endapan yang tidak larut. Larutan yang dihasilkan mengandung empat ion: amonium (NH4)+, sulfat (SO4)2-, kalsium (Ca2+), dan klorida (Cl)-.
T: Bagaimana cara mengendapkan protein dengan amonium sulfat?
A: Untuk mengendapkan protein dengan (NH4)2SO4 dapat dilakukan langkah-langkah sebagai berikut:
- Siapkan larutan encer (NH4)2SO4 yang konsentrasi dan volumenya diketahui.
- Tambahkan larutan protein ke dalam larutan (NH4)2SO4 secara perlahan dan sambil diaduk.
- Pantau kekeruhan atau kepadatan optik campuran untuk menentukan jumlah pengendapan protein.
- Sentrifugasi campuran untuk memisahkan pelet protein dari supernatan.
- Buang supernatan dan cuci pelet protein dengan buffer atau air untuk menghilangkan kelebihan garam.
- Suspensikan kembali atau larutkan pelet protein dalam buffer yang sesuai untuk analisis atau penggunaan lebih lanjut.
Q: Berapa gram dalam 6,90 molekul amonium sulfat?
A: Untuk mengetahui berapa gram dalam 6,90 molekul (NH4)2SO4, kita perlu menggunakan bilangan Avogadro dan massa molar (NH4)2SO4. Bilangan Avogadro adalah 6,022 x 10^23, artinya satu mol suatu zat mengandung banyak molekul. Massa molar (NH4)2SO4 adalah 132,14 g/mol, yang berarti satu mol (NH4)2SO4 memiliki berat sebanyak gram. Oleh karena itu, kita dapat menggunakan rumus ini untuk menghitung berapa gram dalam 6,90 molekul (NH4)2SO4:
gram = molekul x massa molar / Bilangan Avogadro gram = 6,90 x 132,14 / 6,022 x 10^23 gram = 1,52 x 10^-21 Jadi, terdapat 1,52 x 10^-21 gram dalam 6,90 molekul (NH4)2SO4.
T: Berapa kandungan sulfur dalam amonium sulfat?
A: (NH4)2SO4 mengandung 24% sulfur berdasarkan massa. Hal ini dapat dihitung dengan menggunakan rumus persen komposisi dan massa molar belerang dan (NH4)2SO4. Massa molar belerang adalah 32,06 g/mol dan massa molar (NH4)2SO4 adalah 132,14 g/mol. Jadi persentase sulfur dalam (NH4)2SO4 adalah:
persentase = massa molar belerang x 100 / massa molar amonium sulfat persentase = 32,06 x 100 / 132,14 persentase = 24,26%
Q: Manakah dari garam berikut yang merupakan garam netral? na2so4 nacn kf (nh4)2so4
A: Garam netral adalah garam yang tidak mempengaruhi pH larutan bila dilarutkan dalam air. Ini terbentuk oleh reaksi asam kuat dan basa kuat. Dari keempat garam yang diberikan, hanya na2so4 yang merupakan garam netral. Ini terbentuk oleh reaksi natrium hidroksida (basa kuat) dan asam sulfat (asam kuat). Garam lainnya bersifat asam atau basa. Nacn adalah garam basa yang dibentuk oleh reaksi natrium hidroksida (basa kuat) dan asam hidrosianat (asam lemah). Kf adalah garam basa yang dibentuk oleh reaksi kalium hidroksida (basa kuat) dan asam fluorida (asam lemah). (Nh4)2so4 adalah garam asam, dibentuk oleh reaksi amonium hidroksida (basa lemah) dan asam sulfat (asam kuat).
Q: Berapa massa molar (nh4)2so4?
A: Massa molar (nh4)2so4 adalah 132,14 g/mol. Untuk mencari massa molar, kita perlu menjumlahkan massa atom semua atom dalam rumus. Massa atom adalah:
- Nitrogen: 14,01 g/mol
- Hidrogen: 1,01 g/mol
- Belerang: 32,06 g/mol
- Oksigen: 16,00 g/mol
Jadi, massa molar (nh4)2so4 adalah:
(2 x 14,01) + (8 x 1,01) + 32,06 + (4 x 16,00) = 132,14 g/mol
Q: Apakah (nh4)2so4 larut dalam air?
A: Ya, (nh4)2so4 larut dalam air. Ia dapat larut hingga 70,6 gram per 100 gram air pada 0°C, 74,4 gram per 100 gram air pada 20°C, dan 103,8 gram per 100 gram air pada 100°C.
