Amonium nitrat (NH4NO3) adalah senyawa kimia. Ini bisa digunakan sebagai pupuk atau sebagai bahan peledak. Ini sangat larut dalam air dan higroskopis.
| Nama IUPAC | Amonium nitrat |
| Formula molekul | NH4NO3 |
| nomor CAS | 6484-52-2 |
| Sinonim | Garam amonium dari asam nitrat, Amonium nitrat (AN), Amonium nitratum, Nitrame, Nitramon |
| Di ChI | InChI=1S/NO3.H3N/c2-1(3)4;/h;1H3/q-1;/p+1 |
Sifat amonium nitrat
Formula Amonium Nitrat
Amonium nitrat adalah senyawa kimia dengan rumus NH4NO3. Ia terdiri dari dua ion: amonium (NH4+) dan nitrat (NO3-), yang disatukan oleh ikatan ionik 2 . Ini adalah bubuk kristal putih yang mudah larut dalam air.
Massa Molar Amonium Nitrat
Massa molar NH4NO3 adalah 80,043 g/mol. Ini dapat dihitung dengan menjumlahkan massa molar unsur-unsur penyusunnya: nitrogen, hidrogen, dan oksigen. Massa molar nitrogen adalah 14,0067 g/mol, massa molar hidrogen adalah 1,00784 g/mol, dan massa molar oksigen adalah 15,9999 g/mol.
Massa molar NH4NO3 = 2 x massa molar nitrogen + 4 x massa molar hidrogen + 3 x massa molar oksigen
Massa molar NH4NO3 = 28,0134 g/mol + 4,03136 g/mol + 47,9997 g/mol
Massa molar NH4NO3 = 80,043 g/mol
Titik didih amonium nitrat
NH4NO3 tidak memiliki titik didih yang pasti. Ini terurai pada suhu tinggi, melepaskan gas seperti nitrogen, oksigen dan uap air. Suhu penguraian NH4NO3 bervariasi tergantung pada kemurnian, kelembaban dan adanya pengotor atau aditif. Suhu penguraian NH4NO3 murni kira-kira 210°C atau 483 K.
Titik lebur amonium nitrat
Titik leleh NH4NO3 adalah 169,6 °C atau 442,8 K. Ia mengalami transisi fase dari struktur kristal rombohedral ke struktur kristal kubik pada suhu ini. Ia juga dapat membentuk campuran eutektik dengan air, yang memiliki titik leleh lebih rendah sekitar -16 °C atau 257 K.
Massa jenis amonium nitrat g/ml
Massa jenis NH4NO3 adalah 1,725 g/ml atau 1725 kg/m3 pada suhu dan tekanan sekitar. Ini lebih padat dari air, yang memiliki kepadatan sekitar 1 g/ml atau 1000 kg/m3 dalam kondisi yang sama. Kepadatan NH4NO3 berkurang dengan meningkatnya suhu, karena ekspansi termal.
Berat Molekul Amonium Nitrat
Berat molekul NH4NO3 sama dengan massa molarnya, yaitu 80,043 g/mol. Berat molekul adalah massa satu mol atau 6,022 x 10^(23) molekul NH4NO3. Berat molekul juga dapat dinyatakan dalam satuan massa atom (sma), yang didefinisikan sebagai seperdua belas massa atom karbon-12.
Berat molekul NH4NO3 dalam sma adalah 80,043 x (1/12) x (10^(23)) sma
Berat molekul NH4NO3 dalam sma adalah sekitar 6,669 x 10^(23) sma
Struktur amonium nitrat
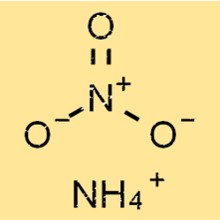
NH4NO3 memiliki struktur ionik sederhana, terdiri dari ion amonium bermuatan positif dan ion nitrat bermuatan negatif. Ion amonium berbentuk tetrahedral, dengan empat atom hidrogen terikat pada atom nitrogen pusat melalui ikatan kovalen.
NH4+
H
|
HNH
|
H
Ion nitrat berbentuk trigonal planar, dengan tiga atom oksigen terikat pada atom nitrogen pusat melalui ikatan kovalen, salah satunya adalah ikatan rangkap.
Nomor 3-
Oh
||
Oh
Kelarutan amonium nitrat
Kelarutan NH4NO3 mengacu pada jumlah senyawa yang larut dalam air atau pelarut lainnya. NH4NO3 sangat larut dalam air dan kelarutannya meningkat seiring dengan suhu. Misalnya, pada suhu 20°C, 150 g NH4NO3 dapat larut dalam 100 ml air, tetapi pada suhu 100°C, 1024 g dapat larut dalam jumlah air yang sama. NH4NO3 juga larut dalam metanol, etanol, dan aseton, tetapi tidak larut dalam dietil eter atau kloroform. Kelarutan NH4NO3 bergantung pada keberadaan zat lain, seperti asam, basa, garam, atau senyawa organik. Beberapa zat tersebut dapat mempengaruhi kestabilan NH4NO3 dan menyebabkannya terurai atau meledak.
| Penampilan | Padatan kristal putih |
| Kepadatan spesifik | 1.725 |
| Warna | Putih atau abu-abu |
| Bau | Tidak berbau |
| Masa molar | 80,043 g/mol |
| Kepadatan | 1,725 g/ml atau 1725 kg/m3 |
| Titik fusi | 169,6°C atau 442,8K |
| Titik didih | Sekitar. 210°C atau 483 K (terurai) |
| Titik kilat | Tidak mudah terbakar |
| Kelarutan dalam air | Endotermik, 118g/100ml (0°C), 150g/100ml (20°C), 297g/100ml (40°C), 410g/100ml (60°C), 576g/100ml (80°C), 1024g /100ml (100°C) |
| Kelarutan | Larut dalam air, metanol, etanol, aseton; tidak larut dalam dietil eter, kloroform |
| Tekanan uap | Dapat diabaikan pada suhu kamar |
| Kepadatan uap | Tidak berlaku (padat) |
| pKa | 9,25 (untuk NH4+) |
| pH | 5.0-6.0 (larutan air 10%) |
Keamanan dan bahaya amonium nitrat
Keamanan dan bahaya NH4NO3 penting untuk diketahui bagi siapa pun yang menangani atau menyimpan senyawa kimia ini. NH4NO3 merupakan oksidator yang dapat memperbesar api dan menyebabkan ledakan jika tercampur dengan bahan yang mudah terbakar atau terkena panas, guncangan, atau kontaminasi. NH4NO3 juga dapat melepaskan gas beracun seperti nitrogen oksida dan amonia ketika terurai. Oleh karena itu, masyarakat harus mengikuti tindakan pencegahan keselamatan berikut saat menangani NH4NO3:
- Simpan di tempat sejuk, kering, berventilasi baik, jauh dari sumber api, bahan organik, asam, logam, dan bahan tidak kompatibel lainnya.
- Kenakan pakaian pelindung, sarung tangan, pelindung mata dan wajah saat menangani.
- Hindari menimbulkan debu dan gunakan ventilasi yang memadai saat memindahkan.
- Cuci tangan dan wajah secara menyeluruh setelah memegang.
- Jangan menelan atau menghirupnya dan konsultasikan dengan dokter jika terjadi paparan.
- Informasikan kepada petugas tanggap darurat setempat mengenai keberadaan NH4NO3 di fasilitas dan siapkan rencana tanggap darurat.
| Simbol bahaya | O (zat pengoksidasi), Xi (iritasi) |
| Deskripsi Keamanan | S17 (jauhkan dari bahan yang mudah terbakar), S26 (jika kena mata, segera bilas dengan banyak air dan dapatkan bantuan medis), S36/37/39 (pakai pakaian pelindung, sarung tangan, dan pelindung mata/wajah yang sesuai), S42 (selama fumigasi/penyemprotan, kenakan peralatan pernapasan yang sesuai) |
| Nomor identifikasi PBB | S17 (jauhkan dari bahan yang mudah terbakar), S26 (jika kena mata, segera bilas dengan banyak air dan dapatkan bantuan medis), S36/37/39 (pakai pakaian pelindung, sarung tangan, dan pelindung mata/wajah yang sesuai), S42 (selama fumigasi/penyemprotan, kenakan peralatan pernapasan yang sesuai) |
| kode HS | 3102.30 (amonium nitrat, dalam larutan air maupun tidak) |
| Kelas bahaya | 5.1 (zat pengoksidasi) |
| Kelompok pengepakan | III (bahaya rendah) |
| Toksisitas | LD50 (oral, tikus) = 2,085-5,300 mg/kg |
Metode sintesis amonium nitrat
Untuk menghasilkan senyawa kimia ini, yang banyak digunakan sebagai pupuk dan bahan peledak, ahli kimia menggunakan berbagai metode sintesis NH4NO3. Ada berbagai metode untuk mensintesis NH4NO3, namun yang paling umum adalah:
- Proses Haber-Bosch dan Ostwald: Metode ini melibatkan reaksi gas nitrogen dan hidrogen untuk membentuk amonia, kemudian mengoksidasi amonia dengan udara untuk membentuk asam nitrat . Untuk membentuk NH4NO3, mereka menetralkan amonia dan asam nitrat. Cara ini membutuhkan suhu, tekanan dan energi yang tinggi serta mengeluarkan banyak karbon dioksida.
- Reaksi metatesis: Metode ini melibatkan reaksi garam amonium yang larut dengan garam nitrat yang larut untuk membentuk NH4NO3 dan garam lainnya. Misalnya, amonium sulfat dan barium nitrat dapat bereaksi membentuk NH4NO3 dan barium sulfat. Cara ini sederhana dan tidak memerlukan suhu atau tekanan tinggi, namun menghasilkan produk sampingan yang mungkin perlu dipisahkan atau dibuang.
- Proses plasma: Metode ini terdiri dari penggunaan plasma pada suhu rendah dan tekanan rendah untuk mengikat nitrogen dari udara di dalam tanah, sehingga membentuk NH4NO3 langsung di dalam tanah. Metode ini tidak memerlukan gas hidrogen atau katalis dan tidak mengeluarkan karbon dioksida. Ini juga dapat memperkaya tanah dengan nitrogen dan meningkatkan pertumbuhan tanaman.
Kegunaan amonium nitrat
Berikut beberapa kegunaan NH4NO3:
- Pupuk: NH4NO3 adalah sumber nitrogen yang umum bagi tanaman, karena mengandung sekitar 33,5% nitrogen, yang semuanya tersedia untuk diserap oleh tanaman. Produsen melapisi pelet amonium karbonat berwarna putih atau abu-abu dengan tanah liat untuk mencegahnya menggumpal dan menyerap kelembapan. Mereka dapat mengaplikasikannya dalam bentuk padat atau larutan karena air mudah larut.
- Bahan peledak: NH4NO3 adalah zat pengoksidasi yang dapat meningkatkan ledakan bahan peledak lainnya, seperti nitrogliserin, TNT, RDX atau bubuk aluminium. Bahan peledak industri yang banyak digunakan, yang mencakup 80% bahan peledak yang digunakan di Amerika Utara, mengandung ANFO (NH4NO3 dan bahan bakar minyak) sebagai bahan utamanya. Dibutuhkan inisiator yang kuat untuk meledakkannya ketika digunakan dalam alat peledak improvisasi, namun aplikasi industri juga dapat menggunakannya.
- Kembang api: Kembang api dapat menggunakan NH4NO3 untuk menciptakan berbagai efek, seperti asap, percikan api, bintang, dan kilat. Kompres dingin juga bisa menggunakannya, yang menghasilkan reaksi endotermik bila dicampur dengan air.
- Kegunaan lain: Digunakan sebagai prekursor dinitrogen oksida (gas ketawa), anestesi dan propelan. Nitrogen oksida dapat digunakan sebagai penyerap, ragi dan antibiotik dapat digunakan sebagai nutrisi, dan campuran freezer dapat digunakan sebagai komponen.
Pertanyaan:
T: Dari mana asal pupuk amonium nitrat?
A: Pupuk NH4NO3 merupakan produk sintetik hasil reaksi amonia dan asam nitrat. Amonia diperoleh dari gas alam atau sumber lain, dan asam nitrat diproduksi dengan mengoksidasi amonia dengan udara. Pupuk NH4NO3 juga dapat diproduksi melalui proses plasma yang mengikat nitrogen dari udara ke dalam tanah.
T: Apa itu amonium nitrat?
A: NH4NO3 adalah senyawa kimia dengan rumus NH4NO3. Ini adalah garam kristal putih yang terdiri dari ion amonium dan nitrat. Ia sangat larut dalam air dan higroskopis dalam bentuk padat, meskipun tidak membentuk hidrat.
T: Untuk apa amonium nitrat digunakan?
J: NH4NO3 terutama digunakan untuk dua tujuan: sebagai pupuk dan sebagai bahan peledak. Sebagai pupuk, ia menyediakan nitrogen bagi tanaman, yang penting untuk pertumbuhan dan metabolismenya. Sebagai bahan peledak, ia bertindak sebagai oksidan yang mendorong ledakan bahan peledak lainnya, seperti ANFO (NH4NO3 dan bahan bakar minyak) 1 . Dapat juga digunakan untuk keperluan lain, seperti pembuatan dinitrogen oksida (gas ketawa), kompres dingin, kembang api, dan nutrisi ragi.
Q: Apa rumus molekul amonium nitrat?
A: Rumus molekul amonium nitrat adalah NH4NO3. Ia memiliki massa molar 80,043 g/mol dan mengandung 35% nitrogen berdasarkan massa.
T: Terbuat dari apakah pupuk amonium nitrat?
J: Pupuk NH4NO3 terdiri dari NH4NO3 dan terkadang bahan tambahan lainnya, seperti tanah liat, bahan anti penggumpalan, atau zat penstabil. Kelas komersial mengandung sekitar 33,5% nitrogen, semuanya dalam bentuk tersedia untuk diserap tanaman.
Q: Apakah amonium nitrat termasuk asam atau basa?
J: NH4NO3 bukanlah asam atau basa, melainkan garam. Ia dapat berdisosiasi dalam air menjadi ion amonium dan nitrat, yang dapat bertindak sebagai asam atau basa lemah tergantung pada pH larutan. Ion amonium memiliki pKa 9,25 yang berarti dapat mendonorkan proton dan berperan sebagai asam dalam larutan basa. Ion nitrat tidak memiliki pKa, artinya ia tidak dapat menyumbangkan atau menerima proton, namun dapat bertindak sebagai basa, membentuk asam nitrat dengan ion hidronium dalam larutan asam.
T: Ledakan amonium nitrat?
J: Ledakan NH4NO3 adalah reaksi kimia hebat yang terjadi ketika NH4NO3 terurai dengan cepat dan melepaskan gas dalam jumlah besar, seperti nitrogen, oksigen, dan uap air. Dekomposisi dapat dipicu oleh panas, guncangan, gesekan, kontaminasi, atau pengurungan. Ledakan NH4NO3 dapat menyebabkan kerusakan serius pada bangunan, manusia, dan lingkungan. Beberapa contoh ledakan NH4NO3 adalah bencana Texas City tahun 1947, ledakan Oppau tahun 1921, ledakan Tianjin tahun 2015, dan ledakan Beirut tahun 2020.
T: Bagaimana cara membeli amonium nitrat?
J: Pembelian NH4NO3 mungkin memerlukan lisensi atau izin tergantung pada negara atau wilayah tempat Anda tinggal. Memang benar, NH4NO3 dapat digunakan untuk membuat bahan peledak atau alat peledak rakitan yang dapat mengancam keselamatan masyarakat. Anda mungkin juga diminta untuk memberikan identitas, alamat, rincian kontak, dan tujuan penggunaan produk Anda saat membeli NH4NO3. NH4NO3 dapat dibeli dari pemasok atau distributor resmi yang mematuhi peraturan dan standar setempat. Anda juga harus mengikuti pedoman penyimpanan dan penanganan yang benar untuk menghindari kecelakaan atau penyalahgunaan NH4NO3.
