Kalium perklorat (KClO4) merupakan senyawa yang mengandung kalium, klorin dan oksigen. Ini umumnya digunakan dalam kembang api dan bahan peledak karena sifat pengoksidasinya.
| Nama IUPAC | Kalium perklorat |
| Formula molekul | KClO4 |
| nomor CAS | 7778-74-7 |
| Sinonim | Percal K, Kalium perklorat, Kalium klorat (VII), UN 1489 |
| Di ChI | InChI=1S/ClHO4.K/c2-1(3,4)5;/h(H,2,3,4,5);/q;+1/p-1 |
Sifat kalium perklorat
Formula Kalium Perklorat
Kalium perklorat memiliki rumus kimia KClO4 yang menunjukkan bahwa ia mengandung satu atom kalium, satu atom klor, dan empat atom oksigen. Senyawa ini merupakan garam anorganik yang sangat larut dalam air, menjadikannya oksidan yang berguna dalam banyak aplikasi.
Massa Molar Kalium Perklorat
Massa molar KClO4 dihitung dengan menjumlahkan massa atom unsur-unsur penyusun senyawa. Massa atom kalium, klor, dan oksigen masing-masing adalah 39,10 g/mol, 35,45 g/mol, dan 16,00 g/mol. Jadi massa molar KClO4 adalah 138,55 g/mol.
Titik didih kalium perklorat
KClO4 tidak memiliki titik didih tertentu karena terurai sebelum mencapai titik didih. Ketika dipanaskan hingga suhu tinggi, KClO4 terurai menjadi kalium klorida dan gas oksigen. Namun, senyawa tersebut telah diamati dapat menyublim pada suhu sekitar 400 hingga 500 °C.
Kalium perklorat Titik lebur
Titik leleh KClO4 kira-kira 610°C. Pada suhu ini, senyawa padat berubah menjadi cair. Titik leleh KClO4 yang tinggi membuatnya cocok digunakan dalam berbagai aplikasi industri.
Massa jenis kalium perklorat g/mL
Massa jenis KClO4 kira-kira 2,52 g/cm³ pada suhu kamar. Hal ini menunjukkan bahwa senyawa tersebut lebih padat dibandingkan air yang mempunyai massa jenis 1 g/cm³. Kepadatan KClO4 yang tinggi menjadikannya oksidan yang efektif dalam kembang api.
Berat Molekul Kalium Perklorat
Berat molekul KClO4 adalah 138,55 g/mol. Nilai ini ditentukan dengan menjumlahkan massa atom unsur-unsur penyusun senyawa. Berat molekul KClO4 berguna dalam menentukan massa senyawa yang dibutuhkan untuk suatu reaksi atau proses tertentu.
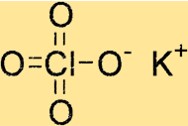
Struktur kalium perklorat
KClO4 memiliki struktur kristal tetragonal, artinya memiliki simetri empat kali lipat di sekitar sumbu cnya. Kisi kristal senyawa tersebut terbentuk dari ion kalium, ion klor, dan ion oksigen, yang disatukan melalui ikatan ionik.
Kelarutan kalium perklorat
KClO4 sangat larut dalam air, dengan kelarutan sekitar 4,5 g/mL pada suhu kamar. Senyawa ini juga larut dalam pelarut polar lainnya seperti etanol dan aseton. Namun, ia tidak larut dalam pelarut non-polar seperti benzena dan kloroform. Kelarutan KClO4 merupakan faktor penting dalam penggunaannya sebagai oksidan dalam berbagai aplikasi industri.
| Penampilan | Padatan kristal putih |
| Kepadatan spesifik | 2.52 |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 138,55 g/mol |
| Kepadatan | 2,52 gram/cm³ |
| Titik fusi | 610°C |
| Titik didih | Terurai sebelum titik didih |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | 4,5 g/mL pada 25°C |
| Kelarutan | Larut dalam etanol dan aseton, tidak larut dalam benzena dan kloroform |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | Netral |
Keamanan dan bahaya kalium perklorat
KClO4 dapat menimbulkan risiko keselamatan jika tidak ditangani dengan benar. Senyawa tersebut merupakan oksidan kuat dan dapat bereaksi dengan bahan yang mudah terbakar sehingga menyebabkan kebakaran atau ledakan. Menghirup debu atau uap KClO4 juga dapat menyebabkan iritasi pada sistem pernapasan. Paparan senyawa ini dalam waktu lama dapat menyebabkan iritasi kulit atau dermatitis. Saat menangani KClO4, penting untuk menggunakan alat pelindung diri yang sesuai seperti sarung tangan, kacamata pengaman, dan respirator. Senyawa tersebut juga harus disimpan di tempat yang sejuk dan kering, jauh dari bahan yang tidak kompatibel serta sumber panas dan nyala api.
| Simbol bahaya | pengoksidasi |
| Deskripsi Keamanan | Jauhkan dari bahan yang mudah terbakar. Kenakan alat pelindung diri yang sesuai. Hindari menghirup debu atau asap. |
| Nomor identifikasi PBB | UN1489 |
| kode HS | 2829.90.90 |
| Kelas bahaya | 5.1 – Zat pengoksidasi |
| Kelompok pengepakan | II |
| Toksisitas | Dapat menyebabkan iritasi kulit atau dermatitis jika terpapar dalam waktu lama. Tertelan atau terhirupnya senyawa ini dapat menyebabkan iritasi pernafasan. |
Metode sintesis kalium perklorat
KClO4 dapat disintesis dengan berbagai metode.
Metode yang umum adalah mereaksikan kalium klorat dengan barium perklorat. Reaksi tersebut menghasilkan KClO4 dan barium klorida sebagai produk sampingan, yang dapat disaring.
Metode lain melibatkan reaksi kalium klorat dengan asam klorida dan natrium klorida. Reaksi tersebut menghasilkan KClO4 dan natrium klorat, yang dapat dipisahkan melalui kristalisasi.
Reaksi antara kalium hidroksida dan amonium perklorat juga dapat mensintesis KClO4. Reaksi tersebut menghasilkan KClO4 dan amonium hidroksida, yang dapat dipisahkan dengan filtrasi.
Metode lain melibatkan reaksi kalium klorida dengan natrium perklorat dengan adanya katalis. Reaksi tersebut menghasilkan KClO4 dan natrium klorida, yang dapat dipisahkan melalui kristalisasi.
Kegunaan Kalium Perklorat
KClO4 memiliki berbagai kegunaan di berbagai industri. Beberapa kegunaan umum adalah:
- Kembang api: Agen pengoksidasi yang populer di industri kembang api. Digunakan dalam pembuatan kembang api, suar dan jenis bahan peledak lainnya.
- Baling-Baling Roket: Digunakan sebagai oksidator dalam pembuatan propelan roket. Biasa digunakan dalam pendorong roket padat dan peluncuran pesawat ulang-alik.
- Inisiator Airbag: Digunakan sebagai inisiator dalam pembuatan airbag. Untuk mengembangkan airbag, muatan listrik dikirim melalui kawat yang dilapisi KClO4. Hal ini menyebabkan reaksi yang menghasilkan gas nitrogen, yang menggembungkan kantung udara.
- Korek api: Digunakan dalam produksi korek api pengaman. Untuk menghasilkan senyawa yang mudah terbakar dan menyala jika terkena permukaan kasar, dicampur dengan antimon sulfida dan belerang.
- Elektroplating: Digunakan dalam industri pelapisan listrik sebagai komponen elektrolit yang digunakan untuk pelapisan logam.
- Obat: Digunakan dalam pengobatan kondisi tiroid seperti hipertiroidisme. Namun, penggunaannya dalam pengobatan telah menurun karena masalah keamanan.
- Kimia analitik: Juga digunakan sebagai reagen dalam kimia analitik untuk penentuan zat tertentu.
Pertanyaan:
T: Jenis ikatan apa yang terkandung dalam molekul kalium perklorat?
J: KClO4 mengandung ikatan ionik dan kovalen. Ion K+ dan ion ClO4- disatukan melalui ikatan ionik, sedangkan ion perklorat sendiri mengandung ikatan kovalen dan ionik.
Q: Apa rumus kalium perklorat?
J: KClO4.
T: Apakah kalium perklorat berbentuk air?
A: KClO4 dapat larut dalam air sehingga menjadi encer pada kondisi tertentu.
T: Untuk apa kalium perklorat digunakan?
J: KClO4 memiliki berbagai kegunaan, termasuk pada kembang api, penguat roket, dan inflator kantung udara. Ini juga digunakan dalam kimia analitik sebagai reagen dan zat pengoksidasi.
Q: Bagaimana cara membuat bubuk flash tanpa kalium perklorat?
A: Flash powder dapat dibuat tanpa KClO4 dengan menggunakan oksidan alternatif, seperti amonium perklorat, natrium perklorat atau barium peroksida.
Q: Berapakah bilangan oksidasi atom klor dalam KClO4?
A: Bilangan oksidasi atom klor individu dalam KClO4 adalah +7.
Q: Apakah KClO4 larut dalam air?
A: Ya, KClO4 larut dalam air.
Q: Apakah KClO4 termasuk asam atau basa?
Jawaban: KClO4 bukanlah asam atau basa. Ini adalah garam yang terdiri dari logam (kalium) dan ion poliatomik (perklorat).
