Magnesium klorat (Mg(ClO3)2) merupakan senyawa yang tersusun dari ion Mg2+ dan ClO3-. Ini adalah bubuk kristal putih yang larut dalam air dan sangat reaktif. Ini dapat digunakan sebagai zat pengoksidasi dalam produksi kembang api dan sebagai desinfektan dalam pengolahan air.
| Nama IUPAC | magnesium klorat |
| Formula molekul | Mg(ClO3)2 |
| nomor CAS | 10326-21-3 |
| Sinonim | Magnesium diperklorat, magnesium(II) klorat, magnesium klorat heksahidrat |
| Di ChI | InChI=1S/2ClHO3.Mg/c2 2-1(3)4;/h2 (H,2,3,4);/q;;+2/p-2 |
Sifat magnesium klorat
Formula Magnesium Klorat
Magnesium klorat adalah senyawa kimia dengan rumus Mg(ClO3)2. Senyawa ini terdiri dari satu ion magnesium (Mg2+) dan dua ion ClO3. Rumus kimianya menyatakan bahwa satu molekul magnesium klorat mengandung dua ion klorida dan enam atom oksigen.
Massa Molar Magnesium Klorat
Massa molar Mg(ClO3)2 adalah 191,2 g/mol. Nilai ini dihitung dengan menjumlahkan berat atom unsur-unsur yang ada dalam molekul Mg(ClO3)2. Magnesium memiliki massa molar 24,31 g/mol, sedangkan klorin dan oksigen memiliki massa molar masing-masing 35,45 g/mol dan 16,00 g/mol. Dengan mengalikan massa molar setiap unsur dengan jumlah atom unsur tersebut dalam molekul dan menjumlahkannya, kita memperoleh massa molar senyawa tersebut.
Titik didih magnesium klorat
Mg(ClO3)2 terurai sebelum mencapai titik didihnya. Ketika dipanaskan, Mg(ClO3)2 terurai menjadi magnesium klorida, gas oksigen, dan gas klor. Oleh karena itu, Mg(ClO3)2 tidak memiliki titik didih.
Magnesium klorat Titik lebur
Titik leleh Mg(ClO3)2 adalah 105°C. Pada suhu ini, senyawa padat berubah bentuk menjadi cair. Titik leleh Mg(ClO3)2 dapat bervariasi tergantung pada kemurnian senyawa dan kondisi pengukurannya.
Massa jenis magnesium klorat g/mL
Massa jenis Mg(ClO3)2 adalah 2,21 g/mL. Artinya satu mililiter Mg(ClO3)2 mempunyai massa 2,21 gram. Massa jenis Mg(ClO3)2 dapat digunakan untuk menghitung volume suatu massa suatu senyawa atau massa suatu volume tertentu dari suatu senyawa.
Berat Molekul Magnesium Klorat
Berat molekul Mg(ClO3)2 adalah 191,2 g/mol. Nilai ini dihitung dengan menjumlahkan berat atom unsur-unsur yang ada dalam molekul Mg(ClO3)2.
Struktur magnesium klorat
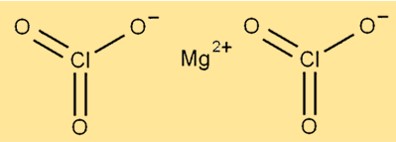
Struktur Mg(ClO3)2 terdiri dari ion magnesium yang dikelilingi oleh enam atom oksigen dan dua atom klor. Ion magnesium terletak di tengah molekul, sedangkan atom oksigen dan klor tersusun di sekelilingnya. Senyawa tersebut mempunyai struktur kristal dan berwarna putih.
Kelarutan magnesium klorat
Mg(ClO3)2 larut dalam air, etanol dan aseton. Kelarutan Mg(ClO3)2 dalam air meningkat seiring suhu. Pada suhu kamar, kurang lebih 31 gram Mg(ClO3)2 dapat larut dalam 100 ml air. Kelarutan Mg(ClO3)2 dalam pelarut lain bergantung pada polaritas pelarut.
| Penampilan | Bubuk kristal putih |
| Berat jenis | 2,21 gram/cm3 |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 191,2 g/mol |
| Kepadatan | 2,21 gram/ml |
| Titik fusi | 105°C |
| Titik didih | Rusak sebelum direbus |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Larut |
| Kelarutan | Larut dalam air, etanol dan aseton |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | Tak dapat diterapkan |
Keamanan dan bahaya magnesium klorat
Mg(ClO3)2 merupakan oksidator kuat dan dapat bereaksi keras dengan bahan yang mudah terbakar, menyebabkan kebakaran atau ledakan. Ini juga dapat menyebabkan iritasi pada kulit, mata dan sistem pernapasan jika bersentuhan atau terhirup. Oleh karena itu, peralatan pelindung diri yang sesuai, seperti sarung tangan dan kaca mata, harus digunakan saat menangani Mg(ClO3)2. Senyawa tersebut juga harus disimpan jauh dari bahan yang mudah terbakar dan sumber panas atau nyala api. Selain itu, ventilasi yang memadai harus disediakan untuk mencegah terhirupnya debu atau uap dari kompleks. Mg(ClO3)2 harus ditangani dengan hati-hati untuk menghindari potensi bahaya.
| Simbol bahaya | pengoksidasi |
| Deskripsi Keamanan | Hindari kontak dengan bahan yang mudah terbakar, kenakan sarung tangan dan kacamata pelindung, pastikan ventilasi yang memadai |
| Nomor identifikasi PBB | UN1475 |
| kode HS | 2829.90.90 |
| Kelas bahaya | 5.1 |
| Kelompok pengepakan | II |
| Toksisitas | Dapat menyebabkan iritasi pada kulit, mata dan saluran pernapasan; mungkin berbahaya jika tertelan |
Metode Sintesis Magnesium Klorat
Metode yang berbeda dapat digunakan untuk mensintesis Mg(ClO3)2.
Metode yang umum adalah mereaksikan magnesium hidroksida dengan asam klorat. Reaksi berlangsung sebagai berikut:
Mg(OH)2 + 2HClO3 → Mg(ClO3)2 + 2H2O
Metode lain adalah dengan mereaksikan magnesium karbonat dengan asam perklorat. Reaksi berlangsung sebagai berikut:
MgCO3 + 2HClO4 → Mg(ClO4)2 + CO2 + H2O
Metode ketiga melibatkan elektrolisis magnesium klorida dengan adanya garam klorat, seperti natrium atau kalium klorat. Reaksi berlangsung sebagai berikut:
2MgCl2 + 2NaClO3 → Mg(ClO3)2 + 2NaCl
Pada metode ini, proses elektrolisis menggunakan anoda magnesium dan menggunakan garam klorat sebagai oksidator.
Kegunaan Magnesium Klorat
Mg(ClO3)2 memiliki berbagai kegunaan di berbagai bidang. Berikut beberapa penerapannya:
- Produk Kembang Api: Biasa digunakan sebagai oksidan dalam komposisi kembang api, seperti suar, kembang api, dan perangkat pemberi sinyal.
- Sintesis kimia: Digunakan sebagai sumber oksigen dalam sintesis berbagai bahan kimia, termasuk obat-obatan, pewarna, dan bahan peledak.
- Pemutih: Digunakan sebagai bahan pemutih dalam produksi kertas, pulp dan tekstil.
- Pengolahan Air: Juga digunakan sebagai bahan pengolahan air untuk menghilangkan kotoran dan bakteri yang ada dalam air.
- Reagen Laboratorium: Digunakan sebagai reagen laboratorium dalam berbagai metode kimia analitik.
- Pertanian: Digunakan sebagai pupuk dan kondisioner tanah untuk menyediakan magnesium dan oksigen bagi tanaman.
- Industri Minyak dan Gas: Digunakan sebagai oksidator dalam operasi pengeboran dan peledakan di industri minyak dan gas.
Pertanyaan:
Q: Apa rumus magnesium klorat?
J: Mg(ClO3)2.
Q: Berapa jumlah atom dalam 2,1 mol Mg(ClO3)2?
A: Terdapat 5,04 x 10^24 atom dalam 2,1 mol Mg(ClO3)2.
T: Magnesium klorat terurai menjadi apa?
A: Mg(ClO3)2 dapat berubah menjadi magnesium klorida, gas oksigen, dan gas klor jika dipanaskan.
T: Bagaimana magnesium klorat terurai?
A: Mg(ClO3)2 terurai menjadi magnesium klorida dan gas oksigen ketika dipanaskan.
Q: Berapa jumlah total atom oksigen yang ada dalam satu unit Mg(ClO3)2?
A: Ada 6 atom oksigen dalam satu unit Mg(ClO3)2.
Q: Mg(ClO3)2 terurai menjadi apa?
A: Mg(ClO3)2 terurai menjadi MgCl2 dan O2 jika dipanaskan.
Q: Berapa jumlah mol atom oksigen yang ada dalam satu mol Mg(ClO3)2?
A: Terdapat 6 mol atom oksigen dalam satu mol Mg(ClO3)2.
Q: Berapa massa Mg(ClO3)2 dalam gram?
A: Massa rumus dalam gram Mg(ClO3)2 adalah 232,21 g/mol.
Q: Apakah Mg(ClO3)2 bersifat ionik atau molekuler?
A: Mg(ClO3)2 merupakan senyawa ionik.
