Kalium hipoklorit (KClO) merupakan senyawa kimia yang biasa digunakan sebagai desinfektan dan pemutih. Baunya menyengat dan bisa berbahaya jika tidak ditangani dengan benar.
| Nama IUPAC | Kalium hipoklorit |
| Formula molekul | KClO |
| nomor CAS | 7778-66-7 |
| Sinonim | Asam hipoklorit, garam kalium; Kalium oksiklorida; Kalium klorat(I) |
| Di ChI | InChI=1S/ClO.K/h1H;/q;+1/p-1 |
Sifat kalium hipoklorit
Formula Kalium Hipoklorit
Rumus kimia kalium hipoklorit adalah KClO. Ini terdiri dari ion kalium, atom klor dan atom oksigen. Kalium hipoklorit berbentuk padatan putih pada suhu kamar dan memiliki bau klorin yang kuat. Ini umumnya digunakan sebagai bahan desinfektan dan pemutih di berbagai industri.
Massa Molar Kalium Hipoklorit
Massa molar KClO adalah 90,55 g/mol. Ini adalah jumlah massa atom unsur-unsur penyusun kalium, klor dan oksigen. Massa molar merupakan parameter penting yang digunakan dalam stoikiometri dan perhitungan kimia lainnya.
Titik didih kalium hipoklorit
KClO terurai sebelum mencapai titik didihnya. Oleh karena itu, titik didihnya tidak dapat ditentukan dengan jelas. Saat dipanaskan, ia terurai menjadi kalium klorida dan gas oksigen. Penguraian KClO merupakan reaksi eksotermik dan dapat berbahaya jika tidak ditangani dengan benar.
Titik lebur kalium hipoklorit
Titik leleh KClO adalah 100 hingga 102°C. Ini adalah padatan putih pada suhu kamar dan meleleh ketika dipanaskan. Titik leleh adalah sifat fisik penting suatu zat dan digunakan untuk mengidentifikasi dan mengkarakterisasi suatu zat.
Massa jenis kalium hipoklorit g/ml
Massa jenis KClO adalah 2,35 g/mL. Artinya satu mililiter KClO beratnya 2,35 gram. Massa jenis adalah ukuran massa per satuan volume suatu zat dan merupakan parameter penting dalam perhitungan kimia.
Berat Molekul Kalium Hipoklorit
Berat molekul KClO adalah 90,55 g/mol. Ini adalah jumlah berat atom unsur-unsur penyusun molekul KClO. Berat molekul digunakan dalam perhitungan kimia seperti menentukan massa molar dan stoikiometri.
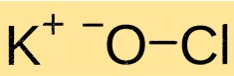
Struktur kalium hipoklorit
KClO memiliki struktur kristal. Ia terdiri dari kation K+ dan anion ClO- yang disatukan melalui ikatan ionik. Struktur KClO mirip dengan senyawa ionik lainnya dan ditentukan oleh muatan dan ukuran ion penyusunnya.
Kelarutan kalium hipoklorit
KClO sangat larut dalam air. Ini membentuk larutan kation K+ dan anion ClO- ketika dilarutkan dalam air. Kelarutan KClO dalam air dipengaruhi oleh suhu dan pH. Suhu yang lebih tinggi dan nilai pH yang lebih rendah meningkatkan kelarutan KClO dalam air.
| Penampilan | Padatan putih |
| Berat jenis | 2.35 |
| Warna | Putih |
| Bau | Bau klorin yang kuat |
| Masa molar | 90,55 g/mol |
| Kepadatan | 2,35g/ml |
| Titik fusi | 100-102°C |
| Titik didih | Terurai sebelum titik didih |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sangat larut |
| Kelarutan | Larut dalam air |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | Basa (pH 11-13) |
Keamanan dan Bahaya Kalium Hipoklorit
KClO bisa berbahaya jika tidak ditangani dengan benar. Ini adalah zat pengoksidasi kuat yang dapat bereaksi dengan bahan organik menghasilkan senyawa berbahaya. KClO juga merupakan iritasi kuat pada kulit, mata dan sistem pernafasan. Kontak langsung dengan kulit dapat menyebabkan luka bakar dan iritasi. Menghirup uap KClO dapat menyebabkan batuk, mengi dan sesak napas. Senyawa ini harus ditangani di area yang berventilasi baik, dengan peralatan pelindung diri yang sesuai seperti sarung tangan, kacamata pelindung, dan respirator. Jika terjadi paparan yang tidak disengaja, perhatian medis segera harus dicari.
| Simbol bahaya | pengoksidasi |
| Deskripsi Keamanan | Kenakan sarung tangan dan pelindung mata/wajah. Jauhkan dari bahan yang mudah terbakar. Hindari kontak dengan kulit dan mata. |
| Nomor identifikasi PBB | UN1748 |
| kode HS | 2828.90.10 |
| Kelas bahaya | 5.1 |
| Kelompok pengepakan | II |
| Toksisitas | Mungkin berbahaya jika tertelan. Menyebabkan luka bakar kulit yang parah dan kerusakan mata. Dapat menyebabkan iritasi pernafasan. |
Metode sintesis kalium hipoklorit
Berbagai metode ada untuk mensintesis kalium hipoklorit.
Metode yang umum adalah mereaksikan gas klor dengan larutan kalium hidroksida . Reaksi menghasilkan KClO dan kalium klorida sebagai produk sampingan:
Cl2 + 2KOH → KCl + KClO + H2O
Metode lain melibatkan reaksi kalsium hipoklorit dengan kalium klorida . Reaksi ini menghasilkan KClO dan kalsium klorida sebagai produk sampingan:
Ca(ClO)2 + 2 KCl → 2 KClO + CaCl2
Untuk mensintesis KClO, asam hipoklorit dapat direaksikan dengan kalium hidroksida .
2 KOH + HOCl → KClO + KCl + H2O
Untuk menghasilkan KClO, elektrolisis dapat digunakan dengan melewatkan arus listrik melalui larutan air dan kalium klorida. Reaksi tersebut menghasilkan KClO, gas hidrogen dan kalium hidroksida sebagai produk sampingan:
2 KCl + 2 H2O → 2 KOH + Cl2 + H2
KClO yang disintesis sebaiknya disimpan di tempat sejuk dan kering, jauh dari sinar matahari langsung dan panas.
Kegunaan Kalium Hipoklorit
KClO memiliki berbagai kegunaan di berbagai industri dan aplikasi. Berikut adalah beberapa kegunaan umum:
- Pengolahan Air: Digunakan sebagai desinfektan di instalasi pengolahan air untuk membunuh bakteri dan organisme berbahaya lainnya.
- Pemutih: Digunakan sebagai bahan pemutih pada industri tekstil untuk memutihkan kain.
- Disinfektan: Digunakan sebagai disinfektan dalam industri makanan untuk mendisinfeksi permukaan dan peralatan yang bersentuhan dengan makanan.
- Pemeliharaan Kolam Renang: Digunakan sebagai desinfektan dan algaesida di kolam renang untuk menjaga air tetap bersih dan jernih.
- Sterilisasi: Digunakan untuk sterilisasi di lingkungan medis dan laboratorium untuk mendisinfeksi peralatan dan permukaan.
- Pewangi: Digunakan sebagai pewangi di pabrik pengolahan limbah untuk menetralisir bau tak sedap.
- Industri Pulp dan Kertas: Digunakan dalam industri pulp dan kertas sebagai pemutih produk kertas.
- Pertanian: Digunakan di bidang pertanian sebagai pestisida dan fungisida untuk melindungi tanaman dari hama dan penyakit.
- Disinfektan: Digunakan sebagai disinfektan pada produk pembersih rumah tangga untuk membunuh kuman dan bakteri.
- Industri Minyak dan Gas: Digunakan dalam industri minyak dan gas untuk mengolah sumur minyak dan jaringan pipa untuk mengendalikan bakteri dan mencegah korosi.
Pertanyaan:
T: Apa itu kalium hipoklorit?
A: Kalium hipoklorit merupakan senyawa kimia dengan rumus KClO yang biasa digunakan sebagai bahan desinfektan, pemutih dan bahan kimia pengolahan air.
Q: Berapa pH larutan KClO 0,42 M? [Ka(HClO) = 4,0 × 10–8]
A: PH larutan KClO 0,42 M dapat dihitung menggunakan nilai Ka dari asam konjugatnya, HClO. PHnya sekitar 12,69.
T: Apa itu natrium hipoklorit dan kalium hidroksida?
A: Natrium hipoklorit adalah senyawa kimia dengan rumus NaClO, biasa digunakan sebagai pemutih dan desinfektan. Kalium hidroksida merupakan senyawa kimia dengan rumus KOH, biasa digunakan dalam produksi sabun dan sebagai reagen laboratorium.
Q: Berapa pH larutan KClO dalam air 0,116 M?
A: PH larutan KClO dalam air 0,116 M dapat dihitung menggunakan nilai Kb basa konjugasinya, ClO-. PHnya sekitar 11,31.
Q: Berapa pH larutan KClO dalam air 0,191 M?
A: PH larutan KClO dalam air 0,191 M dapat dihitung menggunakan nilai Kb basa konjugasinya, ClO-. PHnya sekitar 11,92.
Q: Apakah KClO larut?
A: Ya, KClO larut dalam air dan membentuk larutan basa.
T: Dapatkah saya mencampur natrium hipoklorit dan kalium hipoklorit?
A: Pencampuran natrium hipoklorit dan KClO tidak disarankan karena dapat menyebabkan reaksi kimia yang menghasilkan panas, gas, dan produk samping yang berpotensi membahayakan.
