Kalium tiosulfat (K2S2O3) merupakan senyawa kimia yang digunakan dalam fotografi, sebagai zat pereduksi dan penetralisir klorin di kolam renang. Ini memiliki penampilan kristal putih dan larut dalam air.
| Nama IUPAC | Kalium tiosulfat |
| Formula molekul | K2S2O3 |
| nomor CAS | 10294-66-3 |
| Sinonim | Kalium hiposulfit, kalium tiosulfat, kalium tiosulfat pentahidrat, kalium tiosulfat pentahidrat, kalium sulfurotioat, asam kalium sulfurotioat |
| Di ChI | InChI=1S/2K.H2O3S2/c;;1-4(2)3/jam;;(H2,1,2,3)/q2*+1;/p-2 |
Sifat kalium tiosulfat
Formula Kalium Tiosulfat
Rumus kimia kalium tiosulfat (K2S2O3) menunjukkan jumlah dan jenis atom yang ada dalam senyawa. Rumusnya terdiri dari dua atom kalium, dua atom belerang, dan tiga atom oksigen. Atom kalium bermuatan positif, sedangkan atom belerang dan oksigen bermuatan negatif.
Massa Molar Kalium Tiosulfat
Massa molar K2S2O3 adalah 190,33 g/mol. Massa molar adalah massa satu mol suatu zat dan dihitung dengan menjumlahkan massa atom semua atom dalam rumus kimia. Dalam kasus K2S2O3, rumusnya terdiri dari dua atom kalium, dua atom belerang, dan tiga atom oksigen.
Titik didih kalium tiosulfat
K2S2O3 tidak memiliki titik didih karena terurai sebelum mencapai titik didihnya. Dekomposisi terjadi ketika suhu mencapai sekitar 100°C dan sulfur dioksida dilepaskan. Oleh karena itu, senyawa tersebut umumnya tidak digunakan dalam aplikasi suhu tinggi.
Titik Leleh Kalium Tiosulfat
Titik leleh K2S2O3 adalah 48,3°C. Suhu ini relatif rendah dibandingkan dengan senyawa kimia lainnya. Jika dipanaskan sampai suhu tersebut, padatan K2S2O3 akan menjadi cair.
Massa jenis kalium tiosulfat g/mL
Massa jenis K2S2O3 adalah 1,667 g/mL. Massa jenis adalah ukuran banyaknya massa yang terkandung dalam volume tertentu. Nilai tersebut berarti satu mililiter K2S2O3 mempunyai massa 1,667 gram.
Berat Molekul Kalium Tiosulfat
Berat molekul K2S2O3 adalah 190,33 g/mol. Berat molekul adalah jumlah berat atom seluruh atom dalam suatu senyawa. Ini sering digunakan untuk mengkonversi antara mol dan gram suatu zat.
Struktur kalium tiosulfat
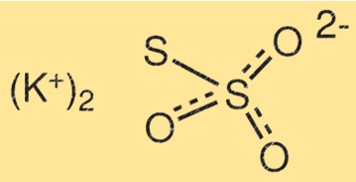
Struktur K2S2O3 terdiri dari dua atom kalium, dua atom belerang, dan tiga atom oksigen. Atom belerang terikat satu sama lain melalui ikatan rangkap, sedangkan atom belerang lainnya terikat pada salah satu atom oksigen. Atom kalium terikat pada atom oksigen yang tersisa.
Kelarutan kalium tiosulfat
K2S2O3 sangat larut dalam air, dengan kelarutan 432 g/L pada 20°C. Hal ini menjadikannya senyawa yang efektif untuk pengolahan air dan sebagai bahan pengikat fotografi. Namun, ia tidak larut dalam pelarut organik seperti etanol atau aseton.
| Penampilan | Padatan kristal putih |
| Berat jenis | 1.667 |
| Warna | Tidak berwarna sampai putih |
| Bau | Tidak berbau |
| Masa molar | 190,33 g/mol |
| Kepadatan | 1,667 gram/mL |
| Titik fusi | 48,3°C |
| Titik didih | Rusak sebelum direbus |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sangat larut (432 g/L pada 20°C) |
| Kelarutan | Tidak larut dalam pelarut organik |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | 6.0 – 9.0 (larutan air 5%) |
Keamanan dan bahaya kalium tiosulfat
K2S2O3 umumnya dianggap aman untuk ditangani dan digunakan jika tindakan pencegahan yang tepat dilakukan. Namun, penting untuk mewaspadai beberapa potensi bahaya yang terkait dengan senyawa ini. Paparan debu atau uap K2S2O3 dapat menyebabkan iritasi pada mata, kulit, dan sistem pernapasan. Menelan senyawa ini juga dapat menyebabkan mual, muntah, dan diare. Selain itu, kontak dengan senyawa tersebut dapat menyebabkan dermatitis atau sensitisasi kulit pada beberapa orang. Seperti halnya bahan kimia lainnya, penting untuk mengikuti protokol keselamatan yang tepat saat menangani K2S2O3 untuk menghindari paparan dan mengurangi risiko kecelakaan.
| Simbol bahaya | XI |
| Deskripsi Keamanan | S22 – Jangan menghirup debu. S24/25 – Hindari kontak dengan kulit dan mata. S37/39 – Kenakan sarung tangan dan pelindung mata/wajah yang sesuai. |
| Nomor identifikasi PBB | PBB 3077 |
| kode HS | 2832.10.00 |
| Kelas bahaya | 9 – Berbagai bahan berbahaya |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | LD50 (oral, tikus): 2,500 mg/kg |
Metode sintesis kalium tiosulfat
K2S2O3 dapat disintesis dengan berbagai metode, termasuk reaksi belerang dengan kalium sulfit dengan adanya logam alkali hidroksida.
Metode lain melibatkan reaksi kalium hidroksida dengan gas belerang dan belerang dioksida. Reaksi ini menghasilkan K2S2O3 dan kalium sulfat sebagai produk samping.
Metode sintesis alternatif melibatkan reaksi kalium sulfit dengan natrium tiosulfat dalam larutan air. Endapan yang dihasilkan dapat disaring dan dicuci hingga diperoleh K2S2O3 murni.
Untuk membuat K2S2O3 di laboratorium, kita dapat mereaksikan kalium hidroksida dengan belerang, kemudian menambahkan gas belerang dioksida ke dalam campuran tersebut. Produk yang dihasilkan berupa padatan kristal putih yang dapat dimurnikan lebih lanjut dengan rekristalisasi.
Kegunaan Kalium Tiosulfat
K2S2O3 memiliki beberapa kegunaan penting di berbagai industri. Berikut beberapa penerapannya yang paling umum:
- Fotografi: Kalium tiosulfat digunakan sebagai bahan pengikat dalam pemrosesan fotografi untuk menghilangkan perak halida yang tidak terpakai dan mencegah pemudaran gambar.
- Pertanian: Kalium tiosulfat digunakan sebagai pupuk untuk menyediakan sulfur dan kalium bagi tanaman, yang merupakan nutrisi penting untuk pertumbuhan dan perkembangan.
- Pengolahan Air: Kalium tiosulfat digunakan untuk menghilangkan klorin dari kolam renang dan air spa, serta untuk menetralkan efek klorin dalam pengolahan air limbah industri.
- Kimia Analitik: Kalium tiosulfat digunakan dalam kimia analitik sebagai zat pereduksi untuk menentukan konsentrasi yodium dan zat pengoksidasi lainnya.
- Perawatan Medis: Kalium tiosulfat telah digunakan dalam beberapa perawatan medis, seperti pengobatan keracunan sianida.
- Aplikasi Industri: Kalium tiosulfat digunakan dalam berbagai aplikasi industri, seperti pelapisan listrik, penyamakan kulit, dan ekstraksi minyak.
Pertanyaan:
T: Bagaimana Anda menentukan apakah suatu benda merupakan zat pereduksi kalium tiosulfat?
J: K2S2O3 merupakan zat pereduksi karena mempunyai kemampuan mendonorkan elektron ke molekul atau ion lain, sehingga menurunkan bilangan oksidasinya.
T: Apa yang menjadikan kalium tiosulfat sebagai zat pereduksi?
J: K2S2O3 memiliki atom belerang dengan bilangan oksidasi lebih rendah daripada sulfat, sehingga memungkinkannya mendonorkan elektron ke molekul atau ion lain dan bertindak sebagai zat pereduksi.
T: Apakah kalium tiosulfat membakar sayuran hijau?
A: Tidak, K2S2O3 tidak membakar sayuran. Ini adalah padatan kristal putih dan tidak menunjukkan warna hijau.
Q: Berapa kelarutan molar AgCl dalam 1,0 M K2S2O3?
A: Kelarutan molar AgCl dalam 1,0 M K2S2O3 bergantung pada berbagai faktor seperti suhu dan kekuatan ion. Nilai pastinya tidak dapat ditentukan tanpa informasi tambahan.
Q: Berapa muatan atau bilangan oksidasi K dalam 2 (K2S2O3)?
A: Muatan atau bilangan oksidasi K dalam 2 (K2S2O3) adalah +1.
Q: Berapakah bilangan oksidasi S dalam K2S2O3?
J: Bilangan oksidasi S dalam K2S2O3 adalah +2.
Q: Berapa jumlah molekul dalam 4 mol K2S2O3?
A: Terdapat sekitar 4 x 6,022 x 10^23 molekul K2S2O3 dalam 4 mol K2S2O3, yang setara dengan 2,409 x 10^24 molekul.
Q: Berapa 4 mol K2S2O3?
A: Massa 4 mol K2S2O3 dapat dihitung dengan mengalikan massa molar K2S2O3 (190,31 g/mol) dengan 4, yaitu 761,24 gram. Jadi, 4 mol K2S2O3 sama dengan 761,24 gram.
