Natrium tiosulfat adalah senyawa kimia dengan rumus Na2S2O3. Ini biasanya digunakan sebagai fiksatif dalam pemrosesan fotografi dan sebagai zat pereduksi dalam reaksi kimia tertentu.
| Nama IUPAC | Natrium tiosulfat |
| Formula molekul | Na2S2O3 |
| nomor CAS | 7772-98-7 |
| Sinonim | Natrium hiposulfit, natrium tiosulfat, garam dinatrium dari asam tiosulfat, natrium tiosulfat pentahidrat |
| Di ChI | InChI=1S/2Na.H2O3S2/c;;1-5(2,3)4/jam;;(H2,1,2,3,4)/q2*+1;/p-2 |
Sifat natrium tiosulfat
Rumus Natrium Tiosulfat
Rumus kimia natrium tiosulfat adalah Na2S2O3. Terdiri dari dua ion Na+ dan dua ion S2O3 2-. Rumusnya menunjukkan jenis dan jumlah atom yang ada dalam suatu molekul senyawa.
Massa Molar Natrium Tiosulfat
Massa molar Na2S2O3 adalah 158,11 g/mol. Ini dihitung dengan menjumlahkan massa atom semua atom yang ada dalam satu mol senyawa. Nilai ini berguna untuk menentukan jumlah Na2S2O3 yang diperlukan untuk suatu reaksi tertentu atau untuk menghitung konsentrasi suatu larutan.
Titik didih natrium tiosulfat
Na2S2O3 tidak memiliki titik didih karena terurai sebelum mencapai titik didihnya. Pada tekanan normal, ia terurai antara 48 dan 55°C, melepaskan sulfur dioksida. Properti ini membuatnya tidak cocok untuk aplikasi suhu tinggi.
Titik lebur natrium tiosulfat
Titik leleh Na2S2O3 adalah 48,3°C. Ini adalah suhu di mana senyawa padat berubah wujud menjadi cair. Titik lelehnya relatif rendah dibandingkan garam anorganik lainnya sehingga mudah larut dalam air.
Massa jenis natrium tiosulfat g/mL
Massa jenis Na2S2O3 adalah 1,667 g/mL. Nilai ini mengacu pada massa suatu zat per satuan volume. Ini lebih besar dari massa jenis air, yang berarti Na2S2O3 tenggelam dalam air.
Berat Molekul Natrium Tiosulfat
Berat molekul Na2S2O3 adalah 158,11 g/mol. Ini adalah jumlah berat atom dari semua atom yang ada dalam molekul senyawa. Berat molekul berguna untuk menentukan jumlah Na2S2O3 yang diperlukan untuk suatu reaksi tertentu atau untuk menghitung konsentrasi suatu larutan.
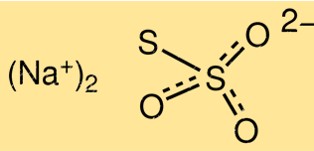
Struktur natrium tiosulfat
Struktur Na2S2O3 terdiri dari dua ion S2O3 2-, terikat pada ion natrium, Na+. Molekulnya berbentuk piramida trigonal dengan sudut ikatan kira-kira 103 derajat. Ion tiosulfat mempunyai satu ikatan sulfur-sulfur dan dua ikatan sulfur-oksigen.
Kelarutan natrium tiosulfat
Na2S2O3 sangat larut dalam air. Kelarutan Na2S2O3 dalam air meningkat seiring suhu, dengan sekitar 70 g senyawa dilarutkan dalam 100 ml air pada suhu 25°C. Ini juga larut dalam gliserol dan sedikit larut dalam alkohol. Kelarutannya membuatnya berguna dalam berbagai aplikasi, seperti pemrosesan fotografi dan perawatan medis.
| Penampilan | Bubuk kristal putih |
| Berat jenis | 1,667 gram/mL |
| Warna | Tidak berwarna sampai putih |
| Bau | Tidak berbau |
| Masa molar | 158,11 g/mol |
| Kepadatan | 1,667 gram/mL |
| Titik fusi | 48,3°C |
| Titik didih | Rusak sebelum direbus |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sangat larut |
| Kelarutan | Larut dalam gliserol dan sedikit larut dalam alkohol |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | Netral (pH 7) |
Keamanan dan bahaya natrium tiosulfat
Na2S2O3 umumnya dianggap aman bila ditangani dengan benar. Namun, bisa berbahaya jika tertelan, terhirup, atau terkena mata atau kulit. Senyawa ini dapat menyebabkan iritasi kulit dan mata, dan paparan yang terlalu lama dapat menyebabkan dermatitis. Menelan Na2S2O3 dapat menyebabkan ketidaknyamanan gastrointestinal, seperti mual dan muntah. Penting untuk memakai alat pelindung diri yang sesuai, seperti sarung tangan dan kacamata pengaman, saat bekerja dengan Na2S2O3. Jika terkena, area yang terkena harus dibilas dengan air dan dicari pertolongan medis jika perlu.
| Simbol bahaya | Tidak ada |
| Deskripsi Keamanan | Hindari kontak dengan mata, kulit dan pakaian. Jangan menelan. Kenakan alat pelindung diri yang sesuai. |
| Nomor identifikasi PBB | UN3077 |
| kode HS | 2832.3010.00 |
| Kelas bahaya | 9 |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | Toksisitas rendah; LD50 (oral, tikus) adalah 6.200 mg/kg |
Metode sintesis natrium tiosulfat
Berbagai metode dapat mensintesis Na2S2O3.
Metode yang umum adalah mereaksikan natrium sulfit dengan belerang dengan adanya larutan basa. Metode lain melibatkan mereaksikan natrium sulfit dengan sulfur dioksida di bawah tekanan.
Salah satu metode pembuatan Na2S2O3 adalah dengan melarutkan belerang dalam larutan panas natrium sulfit dan natrium hidroksida . Solusinya didinginkan dan seseorang menyaringnya untuk mendapatkan produk padat.
Dalam metode ini, sulfur dioksida direaksikan dengan natrium hidroksida menghasilkan natrium sulfit, kemudian direaksikan dengan unsur belerang menghasilkan Na2S2O3.
Untuk menghasilkan Na2S2O3, asam sulfat dapat direaksikan dengan natrium sulfit, kemudian larutan yang dihasilkan dipanaskan dan ditambahkan belerang. Natrium sulfit kemudian akan bereaksi dengan belerang membentuk Na2S2O3.
Metode lain melibatkan mereaksikan natrium hidroksida dengan belerang, diikuti dengan penambahan natrium sulfit untuk membentuk Na2S2O3.
Kegunaan natrium tiosulfat
Na2S2O3 memiliki kegunaan yang luas di berbagai industri dan aplikasi, antara lain:
- Fotografi: Digunakan sebagai bahan pengikat untuk menghilangkan perak halida yang tidak terpapar dari cetakan foto dan film.
- Pengolahan Air: Digunakan untuk mendeklorinasi air dengan menetralkan klorin dan mencegah efek berbahaya pada kehidupan akuatik.
- Aplikasi medis: Digunakan dalam pengobatan keracunan sianida karena bereaksi dengan sianida membentuk tiosianat, yang kurang beracun dan dapat dikeluarkan dari tubuh.
- Aplikasi Industri: Digunakan sebagai zat pereduksi dalam proses kimia dan sebagai pengawet pada tekstil, kulit dan kertas.
- Kimia Analitik: Digunakan sebagai titran dalam analisis berbagai logam, seperti tembaga dan arsenik.
- Industri makanan dan minuman: digunakan sebagai pengawet makanan untuk mencegah perubahan warna dan sebagai penambah rasa.
- Hortikultura: Digunakan untuk menetralisir efek klorin dalam air yang digunakan untuk mengairi tanaman.
Pertanyaan:
T: Untuk apa natrium tiosulfat digunakan?
A: Na2S2O3 memiliki beragam aplikasi, termasuk fotografi, pengolahan air, perawatan medis, proses industri, kimia analitik, pengawetan makanan dan minuman, dan hortikultura.
T: Bagaimana cara membuat natrium tiosulfat?
A: Na2S2O3 dapat disintesis dengan mereaksikan natrium sulfit dengan belerang atau belerang dioksida dengan adanya larutan basa. Metode lain melibatkan mereaksikan natrium hidroksida dengan belerang atau belerang dioksida untuk menghasilkan natrium sulfit, yang kemudian bereaksi dengan belerang menghasilkan Na2S2O3.
T: Apa itu natrium emas tiosulfat?
A: Emas Na2S2O3 adalah senyawa kompleks yang terbentuk dari reaksi emas klorida dan Na2S2O3. Ini digunakan dalam pelapisan emas dan kimia analitik untuk mendeteksi dan mengukur emas.
T: Di mana membeli natrium tiosulfat?
J: Na2S2O3 dapat dibeli dari pemasok bahan kimia, perusahaan pemasok laboratorium, dan pengecer online.
T: Di mana saya dapat menemukan natrium tiosulfat?
J: Na2S2O3 dapat ditemukan dalam berbagai produk, termasuk bahan kimia fotografi, produk pengolahan air, dan perawatan medis.
Q: Berapakah bilangan oksidasi belerang pada Na2S2O3?
A: Bilangan oksidasi belerang dalam Na2S2O3 adalah +2 pada ion tiosulfat (S2O3^2-) dan +6 pada ion sulfat (SO4^2-).
Q: Bagaimana cara mencari berat Cu dari titrasi Na2S2O3?
A: Berat Cu dapat dihitung dari volume dan molaritas larutan Na2S2O3 yang digunakan dalam titrasi, menggunakan persamaan kimia setara untuk reaksi antara Cu dan Na2S2O3.
Q: Bagaimana cara mengetahui jumlah stoikiometri Na2S2O3 yang telah ditambahkan?
A: Na2S2O3 ditambahkan dalam jumlah stoikiometri ketika titik akhir reaksi tercapai, yang ditunjukkan dengan perubahan warna atau sifat fisik atau kimia lainnya.
Q: Jika 5 tetes KI 0,15 M ditambahkan ke dalam 40 tetes Na2S2O3, berapakah konsentrasi akhir KI tersebut?
A: Konsentrasi akhir KI tidak dapat ditentukan tanpa informasi tambahan seperti volume atau konsentrasi larutan Na2S2O3.
Q: Bagaimana cara mencari molaritas Na2S2O3?
A: Molaritas Na2S2O3 dapat dihitung dari massa sampel serta volume dan konsentrasi larutan yang digunakan untuk melarutkannya, dengan menggunakan rumus Molaritas = mol zat terlarut/volume larutan dalam liter.
