Kalium nitrit (KNO2) merupakan senyawa kimia yang biasa digunakan sebagai pengawet makanan. Diketahui dapat menghambat pertumbuhan bakteri dan mencegah pembusukan daging dan makanan lainnya.
| Nama IUPAC | Kalium Nitrit |
| Formula molekul | KNO2 |
| nomor CAS | 7758-09-0 |
| Sinonim | Asam nitrat, garam kalium; sendawa(III); asam nitrat, senyawa. dengan garam kalium (1:1); E249 |
| Di ChI | InChI=1S/K.NO2/c;2-1-3/q+1;-1 |
Sifat kalium nitrit
Formula Kalium Nitrit
Rumus kimia kalium nitrit adalah KNO2. Ini mewakili komposisi senyawa dalam hal atom penyusunnya. Rumus kalium nitrit digunakan untuk menghitung massa molar dan berat molekulnya.
Massa Molar Kalium Nitrit
Massa molar KNO2 adalah 85,103 g/mol. Ini diturunkan dari jumlah massa atom kalium (39,10 g/mol), nitrogen (14,01 g/mol) dan dua atom oksigen (2 x 16,00 g/mol). Massa molar KNO2 sangat penting dalam menentukan berapa banyak zat yang ada dalam suatu massa atau volume tertentu.
Titik didih kalium nitrit
Titik didih KNO2 adalah 320°C (608°F). Pada suhu ini, senyawa berubah dari fasa cair menjadi fasa gas. Titik didih KNO2 bergantung pada berbagai faktor, seperti tekanan dan kemurnian.
Titik Leleh Kalium Nitrit
Titik leleh KNO2 adalah 441°C (826°F). Pada suhu ini, senyawa padat berubah menjadi fase cair. Titik leleh KNO2 merupakan parameter penting dalam menentukan kesesuaiannya untuk berbagai aplikasi, seperti pengawetan makanan dan obat-obatan.
Massa jenis kalium nitrit g/mL
Massa jenis KNO2 adalah 1,915 g/mL pada suhu kamar. Massa jenis suatu zat didefinisikan sebagai massa zat per satuan volume. Kepadatan KNO2 berperan penting dalam menentukan sifat fisiknya, seperti kelarutan dan reaktivitas kimianya.
Berat Molekul Kalium Nitrit
Berat molekul KNO2 adalah 85,103 g/mol. Ini adalah parameter penting untuk menentukan stoikiometri suatu reaksi yang melibatkan KNO2. Berat molekul KNO2 juga digunakan untuk menentukan sifat fisik dan kimianya.
Struktur kalium nitrit
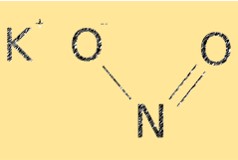
KNO2 memiliki rumus molekul KNO2. Ia memiliki struktur ionik, dengan kation kalium (K+) dan anion nitrit (NO2-). Ion nitrit memiliki geometri molekul melengkung, dengan sudut ikatan kira-kira 115°. Struktur KNO2 sangat penting dalam menentukan sifat kimianya, seperti kelarutan dan reaktivitasnya.
Kelarutan kalium nitrit
KNO2 sangat larut dalam air, dengan kelarutan sekitar 710 g/L pada suhu 20°C. Kelarutan KNO2 bergantung pada berbagai faktor seperti suhu, tekanan dan keberadaan zat lain. Kelarutan KNO2 merupakan parameter penting dalam menentukan kesesuaiannya untuk berbagai aplikasi, seperti pengawetan makanan dan obat-obatan.
| Penampilan | Padatan kristal berwarna putih sampai kekuningan |
| Berat jenis | 1.915 |
| Warna | Tidak berwarna sampai putih |
| Bau | Tidak berbau |
| Masa molar | 85,103 g/mol |
| Kepadatan | 1,915 gram/mL |
| Titik fusi | 441°C (826°F) |
| Titik didih | 320°C (608°F) |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sangat larut (710 g/L pada 20°C) |
| Kelarutan | Larut dalam etanol, sedikit larut dalam amonia |
| Tekanan uap | 0,0038 mmHg pada 25°C |
| Kepadatan uap | 2,96 (udara = 1) |
| pKa | 3.35 |
| pH | 5-8 (larutan 5%) |
Keamanan dan Bahaya Kalium Nitrit
KNO2 bisa berbahaya jika tidak ditangani dengan benar. Ini berbahaya jika tertelan atau terhirup dan dapat menyebabkan iritasi pada mata, kulit dan sistem pernapasan. Paparan KNO2 yang berkepanjangan atau berulang dapat menyebabkan methemoglobinemia, suatu kondisi yang menurunkan kemampuan darah untuk membawa oksigen. KNO2 juga merupakan oksidator kuat dan dapat bereaksi hebat dengan bahan yang mudah terbakar sehingga menyebabkan kebakaran atau ledakan. Tindakan keselamatan yang tepat, seperti penggunaan peralatan pelindung, ventilasi yang memadai, dan penyimpanan yang aman, harus diikuti saat menangani KNO2. Jika tertelan atau terhirup, segera dapatkan bantuan medis.
| Simbol bahaya | Xn |
| Deskripsi Keamanan | S22, S24/25 |
| Nomor identifikasi PBB | PBB 1488 |
| kode HS | 2834.29.10 |
| Kelas bahaya | 5.1 |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | Berbahaya jika tertelan atau terhirup, dapat menyebabkan methemoglobinemia |
Metode sintesis kalium nitrit
Kalium hidroksida (KOH) bereaksi dengan asam nitrat (HNO2) menghasilkan KNO2. Reaksi tersebut menghasilkan KNO2 dan air (H2O) sebagai produk samping. Industri umumnya menggunakan metode ini untuk memproduksi KNO2 dalam jumlah besar.
Persamaan reaksinya adalah:
2 KOH + HNO2 → KNO2 + 2 H2O
Metode lain untuk mensintesis KNO2 adalah dengan mereaksikan kalium karbonat (K2CO3) dengan oksida nitrat (NO). Reaksi tersebut menghasilkan KNO2, karbon dioksida (CO2) dan nitrogen (N2) sebagai produk sampingan. Memperoleh oksida nitrat sulit dan mahal, sehingga metode ini jarang digunakan.
Persamaan reaksinya adalah:
2 K2CO3 + 2 NO → 2 KNO2 + 2 CO2 + N2
KNO2 dapat diperoleh dengan mengoksidasi KNO3 menggunakan zat pereduksi seperti SO2 atau FeSO4.
Reaksi tersebut menghasilkan KNO2, air dan zat pereduksi dalam bentuk tereduksi sebagai produk sampingan. Para ilmuwan lebih jarang menggunakan metode ini dan umumnya menyimpannya untuk sintesis laboratorium skala kecil.
Persamaan reaksi dengan sulfur dioksida adalah:
2 KNO3 + 3 SO2 + H2O → 2 KNO2 + 3 H2SO4
Kegunaan Kalium Nitrit
KNO2 memiliki beberapa aplikasi industri dan laboratorium karena sifat kimianya. Beberapa kegunaan umum KNO2 adalah:
- Pengawetan Makanan: Digunakan sebagai pengawet pada daging yang diawetkan untuk mencegah pertumbuhan bakteri berbahaya dan memperpanjang umur simpannya.
- Industri Kimia: Digunakan sebagai perantara dalam produksi beberapa bahan kimia, seperti asam nitrat, senyawa diazonium, dan nitrit organik.
- Pertanian: Digunakan sebagai pupuk dan kondisioner tanah karena kelarutannya yang tinggi dalam air dan kemampuannya melepaskan nitrogen.
- Reagen Laboratorium: Digunakan sebagai reagen dalam beberapa aplikasi laboratorium, seperti deteksi amina primer dan pembuatan garam diazonium.
- Penggunaan obat: Digunakan dalam pengobatan keracunan sianida karena bereaksi dengan ion sianida membentuk sianmethemoglobin yang tidak beracun.
- Fotografi: Digunakan sebagai bahan tambahan dalam pengembang fotografi untuk meningkatkan kualitas dan kejelasan gambar yang dikembangkan.
- Industri Kaca: Digunakan dalam industri kaca sebagai bahan pemutih untuk menghilangkan pewarna yang tidak diinginkan dari produk kaca.
Pertanyaan:
Apa itu kalium nitrit?
A: KNO2 merupakan senyawa anorganik yang umum digunakan dalam berbagai aplikasi industri dan laboratorium.
Q: Apa rumus kalium nitrit?
A: Rumus kimia kalium nitrit adalah KNO2.
Q: Garam apa yang dihasilkan jika NH4OH bereaksi dengan HNO3? KNO2, NaNO3, NH4NO3 atau NH4NO2?
A: Jika NH4OH bereaksi dengan HNO3, garam yang dihasilkan adalah NH4NO3.
Q: Apakah KNO2 termasuk asam atau basa?
Jawaban: KNO2 merupakan senyawa basa.
Q: Apa nama senyawa yang rumusnya KNO2?
A: Nama senyawa dengan rumus KNO2 adalah kalium nitrit.
Q: Apakah KNO2 termasuk basa lemah?
A: KNO2 dianggap sebagai basa lemah.
Q: Apakah KNO2 bersifat asam atau basa?
A: KNO2 bersifat basa dan dapat bertindak sebagai zat pereduksi ringan.
