Brom (Br2) adalah molekul diatomik yang terdiri dari dua atom brom. Ini adalah cairan coklat kemerahan pada suhu kamar dan sangat reaktif. Ini digunakan di berbagai industri termasuk farmasi, pertanian dan pengolahan air.
| Nama IUPAC | Brom |
| Formula molekul | Br2 |
| nomor CAS | 7726-95-6 |
| Sinonim | Bromo, Brom molekuler, UN 1744, Bromin diatomik, Bromin-79, Bromin-81 |
| Di ChI | InChI=1S/Br2/c1-2 |
Sifat-sifat brom
rumus brom
Rumus kimia brom adalah Br2. Artinya molekul brom mengandung dua atom brom. Rumusnya digunakan untuk mewakili komposisi suatu zat dan penting dalam reaksi kimia. Formula brom digunakan di berbagai industri, termasuk farmasi, pengolahan air, dan pertanian.
Massa Molar Brom
Massa molar Br2 adalah 159,808 g/mol. Ini adalah massa satu mol molekul Br2. Massa molar merupakan sifat penting dalam kimia karena membantu menentukan jumlah zat yang dibutuhkan untuk reaksi tertentu. Ini juga digunakan untuk mengubah gram dan mol suatu zat.
Titik didih brom
Br2 memiliki titik didih 58,8°C (137,8°F). Ini adalah suhu di mana Br2 berubah dari cair menjadi gas. Rendahnya titik didih Br2 disebabkan oleh gaya antarmolekulnya yang lemah, sehingga molekul lebih mudah keluar dari keadaan cair. Reaktivitas Br2 yang tinggi menjadikannya zat yang berbahaya jika ditangani pada suhu tinggi.
Titik leleh brom
Titik leleh Br2 adalah -7,2°C (19,0°F). Ini adalah suhu di mana Br2 padat berubah menjadi cair. Rendahnya titik leleh Br2 disebabkan oleh gaya antarmolekulnya yang lemah, sehingga molekul lebih mudah bergerak dalam keadaan padat. Br2 mempunyai sifat unik yaitu berada dalam bentuk cair pada suhu kamar, yang jarang terjadi pada halogen.
Kepadatan brom g/mL
Massa jenis Br2 adalah 3,12 g/mL. Artinya satu mililiter Br2 mempunyai massa 3,12 gram. Kepadatan Br2 yang tinggi disebabkan oleh berat molekulnya dan ketatnya molekulnya dalam keadaan cair. Kepadatan Br2 yang tinggi membuatnya berguna dalam reaksi sintesis organik berat.
Berat Molekul Brom
Berat molekul Br2 adalah 79,90 g/mol. Ini adalah jumlah berat atom dari dua atom Br dalam molekul Br2. Berat molekul merupakan sifat penting dalam kimia karena membantu menentukan jumlah zat yang dibutuhkan untuk suatu reaksi tertentu.
Struktur brom
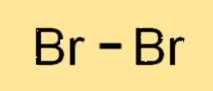
Br2 adalah molekul diatomik, artinya ia terbuat dari dua atom Br yang terikat bersama. Kedua atom Br2 berbagi sepasang elektron membentuk ikatan kovalen. Molekul Br2 memiliki struktur linier, dengan dua atom Br tersusun dalam satu garis lurus. Struktur Br2 mirip dengan halogen lain seperti klor dan yodium.
| Penampilan | Cairan berwarna coklat kemerahan |
| Berat jenis | 3,12 gram/ml |
| Warna | Cokelat kemerahan |
| Bau | Bau yang menyengat dan menjengkelkan |
| Masa molar | 159,808 g/mol |
| Kepadatan | 3,12g/ml |
| Titik fusi | -7,2°C (19,0°F) |
| Titik didih | 58,8°C (137,8°F) |
| Titik kilat | Tidak mudah terbakar |
| Kelarutan dalam air | 3,41g/100ml (25°C) |
| Kelarutan | Larut dalam kloroform, karbon tetraklorida dan eter |
| Tekanan uap | 1,13 kPa pada 25°C |
| Kepadatan uap | 5,4 gram/L |
| pKa | -5 |
| pH | Tak dapat diterapkan |
Keamanan dan bahaya brom
Br2 adalah bahan kimia berbahaya dan harus ditangani dengan hati-hati. Ini adalah cairan korosif yang dapat menyebabkan iritasi serius pada kulit dan mata. Menghirup uap Br2 dapat menyebabkan gangguan pernafasan dan paparan dalam kadar tinggi dapat berakibat fatal. Br2 juga merupakan oksidator kuat dan dapat bereaksi hebat dengan bahan yang mudah terbakar sehingga menyebabkan kebakaran atau ledakan. Peralatan pelindung yang tepat, seperti sarung tangan, kacamata dan respirator, harus selalu dipakai saat bekerja dengan Br2. Ini harus disimpan di tempat yang sejuk, kering, berventilasi baik, jauh dari sumber panas dan bahan yang tidak kompatibel. Jika terjadi tumpahan atau kecelakaan, segera evakuasi area tersebut dan ikuti prosedur pembersihan yang benar.
| Simbol bahaya | Tengkorak dan Tulang Bersilang, Korosif |
| Deskripsi Keamanan | Sangat beracun, korosif dan mengiritasi kulit, mata dan sistem pernapasan. |
| Nomor identifikasi PBB | UN1744 |
| kode HS | 2801.30 |
| Kelas bahaya | 8 |
| Kelompok pengepakan | II |
| Toksisitas | LD50 (oral, tikus) = 2 hingga 3 mg/kg |
Metode sintesis brom
Metode berbeda dapat digunakan untuk mensintesis Br2, bergantung pada kemurnian dan kuantitas yang diinginkan.
Salah satu metode melibatkan pengolahan air garam dengan gas klor dengan adanya katalis seperti besi. Larutan natrium hipoklorit dan natrium klorida yang dihasilkan kemudian diasamkan dengan asam klorida, yang melepaskan gas Br2.
Metode lain melibatkan oksidasi gas hidrogen bromida dengan gas oksigen dengan adanya katalis seperti platina atau asbes. Industri umumnya menggunakan metode ini untuk menghasilkan Br2 dengan kemurnian tinggi untuk aplikasi mereka.
Elektrolisis mengekstrak Br2 dari air garam dengan mengalirkan arus listrik melalui larutan, yang memisahkan ion natrium dan klorida dan menghasilkan gas Br2 sebagai produk sampingan.
Kegunaan Brom
Br2 memiliki beberapa kegunaan penting dalam berbagai industri, antara lain:
- Produsen menggunakan senyawa berbasis Br sebagai penghambat api pada tekstil, plastik, dan peralatan elektronik untuk mengurangi risiko kebakaran dengan mencegah penyebaran api.
- Perusahaan farmasi memasukkan senyawa berbasis Br dalam produksi berbagai obat penenang, obat penenang, dan analgesik.
- Instalasi pengolahan air menggunakan senyawa berbasis Br sebagai disinfektan yang secara efektif membunuh bakteri, virus, dan organisme berbahaya lainnya.
- Produsen pestisida dan herbisida menggunakan senyawa berbasis Br untuk mengendalikan hama dan gulma secara efektif.
- Industri minyak dan gas menggunakan senyawa berbasis Br dalam operasi pengeboran untuk mengendalikan korosi dan meningkatkan perolehan minyak.
- Produsen menggunakan senyawa berbasis Br dalam produksi film dan kertas fotografi untuk mengontrol sensitivitas dan kontras gambar secara efektif.
- Reaksi sintesis kimia menggunakan Br2 sebagai reaktan untuk menghasilkan pewarna, plastik dan obat-obatan.
Pertanyaan:
Q: Apakah Br2 polar atau non-polar?
A: Br2 adalah molekul nonpolar karena kedua atom brom mempunyai keelektronegatifan yang sama, sehingga pembagian elektron dalam ikatan kovalen sama.
Q: Senyawa manakah yang kemungkinan besar mengandung ikatan kovalen polar? NaCl, AlF3, Br2, NF3?
A: Senyawa yang kemungkinan besar mengandung ikatan kovalen polar adalah NF3 (nitrogen trifluorida), karena atom nitrogen dan fluor memiliki keelektronegatifan yang sangat berbeda, sehingga mengakibatkan pembagian elektron yang tidak merata dalam ikatan kovalen.
Q: Berapa ΔH0 untuk reaksi ini? Br2 (g) → Br2 (l), ΔHf° Br2 (g) = 30,91 kJ/mol
A: ΔH0 untuk reaksinya adalah -10,57 kJ/mol, karena kalor penguapan Br2 adalah 41,48 kJ/mol dan kalor peleburan adalah 30,91 kJ/mol (diberikan pada pertanyaan).
T: Apakah Br2 termasuk gas?
A: Br2 dapat berada dalam bentuk gas dan cair tergantung pada kondisi suhu dan tekanan. Pada suhu kamar dan tekanan standar, Br2 berbentuk cairan berwarna coklat kemerahan.
T: Untuk apa bromin digunakan?
J: Brom memiliki beberapa kegunaan penting dalam berbagai industri, termasuk penghambat api, pengolahan air, farmasi, pestisida, industri minyak dan gas, fotografi, dan sintesis kimia.
T: Apakah brom termasuk logam?
J: Tidak, brom bukanlah logam. Ini adalah unsur bukan logam dalam kelompok halogen pada tabel periodik.
