Kalsium sulfat (CaSO4) adalah bubuk putih yang terbentuk secara alami atau diproduksi secara industri. Ini digunakan dalam konstruksi, makanan dan obat-obatan karena sifatnya sebagai pengikat, pengisi dan nutrisi.
| Nama IUPAC | Kalsium sulfat |
| Formula molekul | CaSO4 |
| nomor CAS | 7778-18-9 |
| Sinonim | Gipsum, gipsum anhidrat, anhidrit, dihidrat, garam kalsium, selenit |
| Di ChI | InChI=1S/Ca.H2O4S/c;1-5(2,3)4/jam;(H2,1,2,3,4)/q+2;/p-2 |
Sifat kalsium sulfat
Formula kalsium sulfat
Rumus kimia kalsium sulfat adalah CaSO4. Artinya setiap molekul kalsium sulfat mengandung satu atom kalsium, satu atom sulfur, dan empat atom oksigen. Rumusnya digunakan untuk mewakili komposisi kalsium sulfat dalam persamaan kimia dan untuk menghitung jumlah reaktan yang dibutuhkan dalam reaksi kimia.
Massa Molar Kalsium Sulfat
Massa molar CaSO4 kira-kira 136,14 g/mol. Nilai ini dihitung dengan menjumlahkan massa atom satu atom kalsium, satu atom belerang, dan empat atom oksigen dalam senyawa. Massa molar digunakan untuk menentukan jumlah CaSO4 yang dibutuhkan dalam reaksi kimia dan menghitung konsentrasinya dalam larutan.
Titik didih kalsium sulfat
CaSO4 tidak memiliki titik didih tertentu karena ia mengalami dekomposisi termal sebelum mencapai titik didihnya. Namun, dapat dipanaskan hingga suhu di atas 200°C tanpa mengalami dekomposisi. Pada suhu yang lebih tinggi, CaSO4 mengalami dekomposisi endotermik membentuk kalsium oksida dan sulfur trioksida.
Titik Leleh Kalsium Sulfat
Titik leleh CaSO4 bergantung pada keadaan hidrasinya. Bentuk CaSO4 anhidrat memiliki titik leleh sekitar 1460°C, sedangkan bentuk dihidrat memiliki titik leleh lebih rendah sekitar 128°C. Bentuk hemihidrat dan trihidrat memiliki titik leleh menengah.
Massa jenis kalsium sulfat g/mL
Kepadatan CaSO4 bergantung pada bentuk dan keadaan hidrasinya. Bentuk CaSO4 anhidrat memiliki kepadatan sekitar 2,96 g/mL, sedangkan bentuk dihidrat memiliki kepadatan sekitar 2,32 g/mL. Bentuk hemihidrat dan trihidrat mempunyai kepadatan menengah.
Berat Molekul Kalsium Sulfat
Berat molekul CaSO4 kira-kira 136,14 g/mol. Nilai ini dihitung dengan menjumlahkan massa atom satu atom kalsium, satu atom belerang, dan empat atom oksigen dalam senyawa. Berat molekul digunakan untuk menghitung jumlah CaSO4 yang dibutuhkan dalam reaksi kimia dan untuk menentukan konsentrasinya dalam larutan.
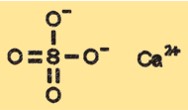
Struktur kalsium sulfat
CaSO4 memiliki struktur kristal yang dapat bervariasi tergantung pada keadaan hidrasinya. Bentuk CaSO4 anhidrat memiliki struktur kristal yang tergolong ortorombik, sedangkan bentuk dihidrat memiliki struktur kristal monoklinik. Bentuk hemihidrat dan trihidrat memiliki struktur kristal berbeda yang merupakan perantara antara bentuk anhidrat dan dihidrat.
| Penampilan | Bubuk putih atau padat |
| Berat jenis | 2,96 (anhidrat), 2,32 (dihidrat) |
| Warna | Putih atau tidak berwarna |
| Bau | Tidak berbau |
| Masa molar | 136,14 g/mol |
| Kepadatan | 2,96 g/cm³ (anhidrat), 2,32 g/cm³ (dihidrat) |
| Titik fusi | 1460°C (anhidrat), 128°C (dihidrat) |
| Titik didih | Tidak mempunyai titik didih yang pasti |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | 0,24g/100ml (20°C) |
| Kelarutan | Larut dalam air dan gliserol, tidak larut dalam etanol |
| Tekanan uap | Dapat diabaikan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | 9.8 (disosiasi pertama), 11.8 (disosiasi kedua) |
| pH | 7 (netral) |
Keamanan dan bahaya kalsium sulfat
CaSO4 umumnya dianggap aman untuk digunakan dan ditangani, namun dapat menimbulkan beberapa risiko kesehatan jika tidak ditangani dengan benar. Menghirup debu CaSO4 dapat menyebabkan iritasi pada sistem pernapasan, sedangkan jika tertelan dalam jumlah besar dapat menyebabkan gangguan pencernaan. Kontak mata dan kulit dengan CaSO4 dapat menyebabkan iritasi atau kekeringan. CaSO4 juga dapat bereaksi dengan bahan kimia tertentu menghasilkan produk sampingan yang berbahaya. Oleh karena itu, peralatan pelindung diri yang sesuai harus dipakai saat menangani CaSO4 dan harus disimpan di tempat yang sejuk, kering, dan berventilasi baik, jauh dari bahan yang tidak kompatibel.
| Simbol bahaya | Tidak ada |
| Deskripsi Keamanan | Berbahaya jika tertelan. Menyebabkan iritasi kulit dan mata. |
| Nomor identifikasi PBB | Tidak diatur |
| kode HS | 2833.29.00 |
| Kelas bahaya | Tidak diklasifikasikan sebagai bahan atau campuran berbahaya menurut Peraturan (EC) No 1272/2008 [CLP] |
| Kelompok pengepakan | Tak dapat diterapkan |
| Toksisitas | LD50 (oral, tikus): > 2000 mg/kg |
Metode sintesis kalsium sulfat
Beberapa metode memungkinkan CaSO4 disintesis tergantung pada bentuk yang diinginkan dan keadaan hidrasi senyawa.
Metode yang umum adalah mereaksikan kalsium karbonat atau kalsium oksida dengan asam sulfat. Reaksi tersebut masing-masing menghasilkan CaSO4 dan karbon dioksida atau air.
Metode lain melibatkan reaksi kalsium klorida dengan natrium sulfat , menghasilkan pengendapan CaSO4. Dehidrasi termal gipsum, suatu bentuk mineral alami CaSO4 dihidrat, menghasilkan CaSO4.
Beberapa proses industri, seperti desulfurisasi gas buang pembangkit listrik, menghasilkan CaSO4 sebagai produk sampingan. Selama proses ini, sulfur dioksida bereaksi dengan kalsium karbonat membentuk kalsium sulfit, yang mengalami oksidasi menghasilkan CaSO4.
Metode sintesis yang digunakan untuk CaSO4 dapat mempengaruhi sifat-sifatnya, seperti ukuran partikel, kristalinitas, dan kemurnian. Oleh karena itu penting untuk memilih metode yang sesuai dengan tujuan penerapan senyawa tersebut.
Kegunaan Kalsium Sulfat
CaSO4 memiliki banyak kegunaan di berbagai industri karena sifat uniknya termasuk toksisitas rendah, titik leleh tinggi, dan warna putih. Beberapa kegunaan umum CaSO4 meliputi:
- Konstruksi: Komponen penting dari semen dan eternit, yang berfungsi sebagai pengikat dan dempul.
- Makanan dan Minuman: Digunakan sebagai koagulan dalam produksi tahu dan sebagai bahan pengencang pada beberapa keju dan sayuran kaleng.
- Farmasi: Digunakan sebagai pengisi dan pengikat dalam produksi tablet dan kapsul.
- Pertanian: Digunakan sebagai bahan pembenah tanah untuk memperbaiki struktur tanah dan meningkatkan hasil panen.
- Bahan kimia: Digunakan dalam produksi berbagai bahan kimia, seperti pigmen, kertas, dan pengolahan tekstil.
- Kosmetik: Digunakan dalam formulasi kosmetik sebagai bahan penggembur dan pengabur.
- Pengolahan Air: Digunakan dalam pengolahan air untuk menghilangkan kotoran dan mengurangi kerak.
- Plastik dan Karet: Digunakan sebagai bahan pengisi dan penguat pada produk plastik dan karet.
Pertanyaan:
T: Apakah kalsium sulfat vegan?
A: Ya, CaSO4 dianggap vegan karena tidak berasal dari sumber hewani.
T: Apa kegunaan utama kalsium sulfat di rumah sakit?
A: CaSO4 biasa digunakan di rumah sakit sebagai gips untuk patah tulang.
T: Berapa massa kalsium sulfat dan fosfor?
J: Pertanyaan ini tidak lengkap dan memerlukan lebih banyak informasi untuk memberikan jawaban spesifik.
Q: Apakah CaSO4 larut dalam air?
A: CaSO4 memiliki kelarutan yang rendah dalam air, dengan kelarutan sekitar 2,05 g/L pada suhu kamar.
Q: Apakah CaSO4 larut?
A: Kalsium sulfat memiliki kelarutan yang rendah dalam air, dengan kelarutan sekitar 2,05 g/L pada suhu kamar.
Q: Berapa massa molar CaSO4?
J: Massa molar CaSO4 kira-kira 136,14 g/mol.
Q: Garam manakah yang memiliki pH <7? KBr, HCOOK, CaSO4, NH4NO3
J: Tidak ada garam yang terdaftar yang memiliki pH <7 dalam bentuk murninya. Namun bila dilarutkan dalam air, NH4NO3 (amonium nitrat) akan menghasilkan larutan asam dengan pH <7.
