Kalium bikarbonat (KHCO3) berfungsi sebagai garam kristal putih, banyak digunakan sebagai bahan sisa dalam pembuatan kue, sebagai bahan pemadam kebakaran, dan untuk menetralkan keasaman tanah di bidang pertanian. Selain itu, ia bertindak sebagai suplemen nutrisi dan berperan dalam perawatan medis tertentu.
| Nama IUPAC | Kalium hidrogen karbonat |
| Formula molekul | KHCO3 |
| nomor CAS | 298-14-6 |
| Sinonim | Kalium hidrogen karbonat, garam asam kalium, kalium hidrogen karbonat, PCN 0775, E501 |
| Di ChI | InChI=1S/CH2O3.K/c2-1(3)4;/h(H2,2,3,4);/q;+1/p-1 |
Sifat kalium bikarbonat
Formula Kalium Bikarbonat
Rumus kalium bikarbonat adalah KHCO3. Rumus ini menunjukkan bahwa ion kalium (K+) bergabung dengan ion bikarbonat (HCO3-) membentuk molekul kalium bikarbonat. Rumus penting dalam kimia karena memberikan informasi tentang jenis dan jumlah atom penyusun suatu molekul.
Massa Molar Kalium Bikarbonat
KHCO3 memiliki massa molar 100,115 g/mol. Artinya satu mol KHCO3 mengandung 100,115 gram senyawa tersebut. Massa molar merupakan sifat penting suatu senyawa karena digunakan untuk menghitung jumlah zat yang dibutuhkan untuk suatu reaksi kimia. Selain itu, massa molar dapat digunakan untuk mengubah gram dan mol suatu zat.
Titik didih kalium bikarbonat
Titik didih KHCO3 tidak dapat ditentukan dengan jelas karena ia terurai sebelum mencapai titik didihnya. Saat dipanaskan, KHCO3 terurai menjadi kalium karbonat, karbon dioksida dan air. Oleh karena itu, suhu dekomposisi KHCO3 digunakan untuk menggambarkan stabilitas termalnya.
Titik Leleh Kalium Bikarbonat
KHCO3 memiliki titik leleh 292°C. Pada suhu ini, KHCO3 berubah wujud dari padat menjadi cair. Titik leleh suatu senyawa merupakan sifat fisik yang penting karena menentukan kondisi di mana senyawa dapat dicairkan dan diproses.
Massa jenis kalium bikarbonat g/mL
Massa jenis KHCO3 adalah 2,17 g/mL. Massa jenis adalah ukuran jumlah massa per satuan volume. Kepadatan KHCO3 yang tinggi menjadikannya senyawa yang berguna dalam aplikasi seperti alat pemadam kebakaran, yang digunakan untuk memadamkan kebakaran Kelas B.
Berat Molekul Kalium Bikarbonat
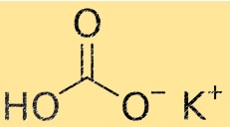
Berat molekul KHCO3 adalah 100,115 g/mol. Berat molekul adalah jumlah berat atom seluruh atom dalam suatu molekul. Sifat ini penting dalam kimia karena digunakan untuk menghitung jumlah suatu zat yang dibutuhkan untuk suatu reaksi kimia.
Struktur kalium bikarbonat
KHCO3 memiliki struktur kristal yang mirip dengan natrium klorida. Senyawa tersebut tersusun atas ion kalium (K+) dan ion bikarbonat (HCO3-). Ion kalium menempati posisi ion natrium dalam struktur kristal natrium klorida, sedangkan ion bikarbonat menempati posisi ion klorida.
| Penampilan | Bubuk kristal putih |
| Berat jenis | 2,17 gram/cm³ |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 100,115 g/mol |
| Kepadatan | 2,17 gram/cm³ |
| Titik fusi | 292°C |
| Titik didih | Rusak sebelum direbus |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | 25g/100ml (20°C) |
| Kelarutan | Larut dalam air |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | 10.3 (asam karbonat) |
| pH | 8,5 – 9,5 (larutan 1%) |
Keamanan dan bahaya kalium bikarbonat
KHCO3 umumnya dianggap aman bila digunakan sesuai petunjuk. Namun, hal ini dapat menyebabkan iritasi kulit dan mata dan harus ditangani dengan hati-hati. Ini juga bisa berbahaya jika tertelan dalam jumlah banyak. Menghirup debu dapat menyebabkan iritasi saluran pernapasan. Selain itu, ia dapat bereaksi dengan asam kuat untuk melepaskan karbon dioksida, yang bisa berbahaya. Saat menggunakan KHCO3, penting untuk mengikuti prosedur keselamatan dan memakai peralatan pelindung yang sesuai. Jika tertelan, segera dapatkan bantuan medis. Jika terjadi kontak dengan kulit atau mata, basuh area yang terkena secara menyeluruh dengan air dan dapatkan bantuan medis jika iritasi masih berlanjut.
| Simbol bahaya | Tidak ada |
| Deskripsi Keamanan | Berbahaya jika tertelan, menyebabkan iritasi kulit dan mata. Hindari menghirup. |
| Nomor identifikasi PBB | PBB 2987 |
| kode HS | 2836.30.00 |
| Kelas bahaya | 8 (Korosif) |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | LD50 (tikus, oral): 6.400 mg/kg |
Metode sintesis kalium bikarbonat
Dengan adanya air, karbon dioksida bereaksi dengan kalium karbonat untuk mensintesis KHCO3.
Reaksinya terjadi sebagai berikut:
K2CO3 + CO2 + H2O → 2KHCO3
Metode lain adalah dengan mereaksikan kalium hidroksida dengan karbon dioksida:
KOH + CO2 → KHCO3
KHCO3 yang dihasilkan kemudian dapat dimurnikan dengan cara rekristalisasi dari air. Hasil reaksi bergantung pada kemurnian bahan mentah dan kondisi reaksi.
Untuk menghasilkan KHCO3, kalium klorida dapat direaksikan dengan amonium bikarbonat, kemudian diolah dengan karbon dioksida.
NH4HCO3 + KCl → NH4Cl + KHCO3
KHCO3 + CO2 → K2CO3 + H2O
K2CO3 + CO2 + H2O → 2KHCO3
Keuntungan dari metode ini adalah penggunaan bahan baku yang murah dan tidak menghasilkan produk samping yang berbahaya.
Kegunaan Kalium Bikarbonat
KHCO3 memiliki kegunaan yang luas di berbagai industri dan aplikasi. Berikut adalah beberapa kegunaan yang paling umum:
- Industri makanan: Digunakan sebagai bahan sisa pada makanan yang dipanggang, seperti kue, kue kering, dan roti, untuk membantunya mengembang.
- Pertanian: Digunakan sebagai fungisida untuk mengendalikan penyakit tanaman jamur, seperti embun tepung.
- Obat-obatan: Digunakan dalam antasida untuk menetralkan asam lambung dan mengobati gangguan pencernaan dan mulas.
- Alat Pemadam Kebakaran: Digunakan dalam alat pemadam kebakaran sebagai bahan kimia kering untuk memadamkan kebakaran Kelas B dan Kelas C.
- Aplikasi Laboratorium: Digunakan dalam berbagai aplikasi laboratorium, seperti buffering pH dan kultur sel.
- Produk perawatan pribadi: Digunakan dalam pasta gigi sebagai bahan abrasif ringan dan deodoran untuk membantu mengendalikan bau.
- Pengolahan Air: Digunakan dalam pengolahan air untuk mengatur tingkat pH dan menghilangkan logam berat dan kotoran lainnya.
Pertanyaan:
T: Apa itu kalium bikarbonat?
A: KHCO3 berbentuk bubuk berwarna putih tidak berbau yang biasa digunakan di berbagai industri, seperti makanan, pertanian, dan farmasi. Ia memiliki rumus kimia KHCO3 dan merupakan garam yang terdiri dari kation kalium, anion bikarbonat, dan molekul air.
T: Apakah bikarbonat dalam tablet kalium effervescent berubah menjadi karbon dioksida?
J: Ya, ketika tablet kalium effervescent dilarutkan dalam air, bikarbonat dalam tablet bereaksi dengan asam sitrat untuk melepaskan karbon dioksida. Reaksi ini menghasilkan karakteristik mendesis dan menggelembung yang berhubungan dengan tablet effervescent.
T: Apa yang terjadi setelah menambahkan kalium bikarbonat ke dalam anggur?
MEMILIKI: Menambahkan KHCO3 ke dalam anggur mengurangi keasaman anggur dengan bereaksi dengan kelebihan asam yang ada. Pembuat anggur biasanya menggunakan proses ini, yang disebut deasidifikasi, untuk meningkatkan rasa dan kualitas anggur.
T: Dimana membeli kalium bikarbonat?
A: KHCO3 dapat dibeli dari berbagai pemasok bahan kimia, pasar online, dan toko perlengkapan pertanian. Ini juga biasanya tersedia di toko makanan kesehatan dan pasar makanan kesehatan.
Q: Apa nama senyawa yang rumusnya KHCO3?
A: Senyawa dengan rumus KHCO3 disebut kalium bikarbonat.
T: Apa yang dilakukan dalam percobaan tersebut untuk memastikan bahwa semua KHCO3 telah bereaksi?
A: Dalam percobaan untuk memastikan bahwa semua KHCO3 telah bereaksi, kelebihan asam ditambahkan ke dalam campuran reaksi dan reaksi dilanjutkan sampai tidak ada lagi gas yang dihasilkan. Tidak adanya gas menunjukkan bahwa seluruh KHCO3 telah bereaksi dengan asam.
Q: Apa yang terjadi jika KHCO3 dipanaskan?
A: Ketika KHCO3 dipanaskan, ia terurai menjadi kalium karbonat (K2CO3), air dan karbon dioksida. Reaksi ini terjadi sebagai berikut: 2KHCO3 → K2CO3 + H2O + CO2.
