Kalsium bikarbonat (Ca(HCO3)2) merupakan senyawa yang mengandung kalsium, karbon dan oksigen. Ini umumnya ditemukan dalam air mineral dan penting untuk kesehatan tulang dan fungsi otot.
| Nama IUPAC | Kalsium hidrogen karbonat |
| Formula molekul | Ca(HCO3)2 |
| nomor CAS | 3983-19-5 |
| Sinonim | Kalsium hidrogen karbonat, kalsium hidrogen karbonat, kalsium bikarbonat terhidrasi, kalsium hidrogen karbonat terhidrasi, EINECS 223-070-3 |
| Di ChI | InChI=1S/C2H2O3.Ca/c3-1(4)2(5)6;/h(H2,3,4)(H,5,6);/q;+2/p-2 |
Sifat kalsium bikarbonat
Formula Kalsium Bikarbonat
Rumus kimia kalsium bikarbonat adalah Ca(HCO3)2. Hal ini menunjukkan bahwa senyawa tersebut terdiri dari satu ion Ca2+ dan dua ion HCO3-. Rumusnya penting untuk memahami komposisi senyawa dan sifat kimianya. Ca(HCO3)2 dapat dibentuk dengan melarutkan kalsium karbonat dalam air berkarbonasi atau dengan mereaksikan kalsium hidroksida dengan karbon dioksida.
Massa Molar Kalsium Bikarbonat
Massa molar Ca(HCO3)2 adalah 162,114 g/mol. Ini dihitung dengan menjumlahkan massa atom setiap unsur dalam senyawa. Ca(HCO3)2 mengandung atom kalsium, hidrogen, karbon, dan oksigen, dan massa molar mencerminkan massa gabungan semua atom tersebut. Mengetahui massa molar penting untuk menentukan jumlah Ca(HCO3)2 yang dibutuhkan untuk reaksi kimia atau untuk menentukan konsentrasi suatu larutan.
Titik didih kalsium bikarbonat
Ca(HCO3)2 terurai sebelum mencapai titik didihnya. Pada tekanan atmosfer normal, Ca(HCO3)2 terurai menjadi kalsium karbonat, air dan karbon dioksida pada suhu di atas 50°C. Oleh karena itu, ia tidak memiliki titik didih.
Titik Leleh Kalsium Bikarbonat
Ca(HCO3)2 tidak memiliki titik leleh yang jelas karena ia terurai sebelum mencapai titik lelehnya. Ini terurai menjadi kalsium karbonat, air dan karbon dioksida pada suhu di atas 50°C. Namun, dekomposisi termal Ca(HCO3)2 dapat digunakan untuk menghasilkan kalsium oksida, yang memiliki titik leleh tinggi yaitu 2613°C.
Massa jenis kalsium bikarbonat g/mL
Massa jenis Ca(HCO3)2 adalah 2,21 g/mL. Artinya satu sentimeter kubik Ca(HCO3)2 beratnya 2,21 gram. Massa jenis Ca(HCO3)2 lebih rendah dibandingkan massa jenis kalsium karbonat, yaitu 2,71 g/mL. Massa jenis suatu zat penting dalam menentukan massa suatu zat per satuan volume dan dapat digunakan untuk menghitung konsentrasi suatu larutan.
Berat Molekul Kalsium Bikarbonat
Berat molekul Ca(HCO3)2 adalah 162,114 g/mol. Nilai ini dihitung dengan menjumlahkan berat atom kalsium, hidrogen, karbon dan oksigen dalam senyawa. Berat molekul penting dalam menentukan jumlah Ca(HCO3)2 yang dibutuhkan untuk reaksi kimia dan dalam menentukan konsentrasi suatu larutan.
Struktur kalsium bikarbonat
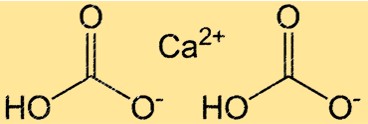
Ca(HCO3)2 memiliki struktur yang kompleks karena adanya ikatan ionik dan kovalen. Senyawa tersebut terdiri dari satu ion Ca2+ dan dua ion HCO3- yang disatukan melalui ikatan ionik. Ion HCO3- sendiri merupakan ion poliatomik yang terdiri dari satu atom karbon, dua atom oksigen, dan satu atom hidrogen. Atom karbon terikat ganda pada satu atom oksigen dan terikat tunggal pada atom oksigen lainnya, dan atom hidrogen terikat pada salah satu atom oksigen. Struktur Ca(HCO3)2 penting untuk memahami reaktivitas dan kelarutannya dalam air.
| Penampilan | bubuk putih |
| Berat jenis | 2,21 gram/cm³ |
| Warna | Tanpa warna |
| Bau | Tidak berbau |
| Masa molar | 162,114 g/mol |
| Kepadatan | 2,21 gram/ml |
| Titik fusi | Terurai di atas 50°C |
| Titik didih | Terurai di atas 50°C |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Larut |
| Kelarutan | Larut dalam air, tidak larut dalam alkohol |
| Tekanan uap | Dapat diabaikan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | 6.4 – 10.3 |
| pH | 8.2 – 8.4 |
Keamanan dan bahaya kalsium bikarbonat
Ca(HCO3)2 umumnya dianggap aman untuk digunakan dalam makanan dan minuman oleh badan pengawas. Namun, menghirup debu Ca(HCO3)2 dapat menyebabkan iritasi saluran pernafasan. Kontak dengan mata dapat menyebabkan iritasi atau kerusakan kornea. Menelan Ca(HCO3)2 dalam jumlah besar dapat menyebabkan iritasi saluran cerna. Penanganan Ca(HCO3)2 juga dapat menyebabkan iritasi kulit atau dermatitis pada individu yang sensitif. Penting untuk mengikuti prosedur penanganan yang benar ketika bekerja dengan Ca(HCO3)2, seperti memakai sarung tangan dan kacamata pelindung. Selain itu, penting untuk menyimpan Ca(HCO3)2 di tempat sejuk, kering, dan jauh dari zat yang tidak kompatibel.
| Simbol bahaya | Tidak ada |
| Deskripsi Keamanan | Tidak beracun dan aman |
| Nomor identifikasi PBB | T/A |
| kode HS | 2836.50.00 |
| Kelas bahaya | Tidak berbahaya |
| Kelompok pengepakan | T/A |
| Toksisitas | Tidak beracun dan aman |
Metode sintesis kalsium bikarbonat
Reaksi kalsium karbonat (CaCO3) dengan karbon dioksida (CO2) dan air (H2O) menghasilkan Ca(HCO3)2. Reaksi ini dapat terjadi secara alami di perairan tertentu, yang terdapat karbon dioksida dan kalsium karbonat .
Untuk menghasilkan Ca(HCO3)2, karbon dioksida dapat dilewatkan melalui larutan kalsium hidroksida (Ca(OH)2) . Reaksi ini membentuk kalsium karbonat , yang kemudian bereaksi dengan karbon dioksida berlebih membentuk Ca(HCO3)2.
Metode lain untuk mensintesis Ca(HCO3)2 melibatkan mereaksikan kalsium klorida (CaCl2) dengan natrium bikarbonat (NaHCO3). Reaksi ini menghasilkan Ca(HCO3)2 serta natrium klorida (NaCl) dan karbon dioksida.
Penting untuk dicatat bahwa Ca(HCO3)2 adalah senyawa yang relatif tidak stabil dan terurai menjadi kalsium karbonat dan karbon dioksida jika terkena panas atau kondisi asam. Untuk menghindari penguraian, Ca(HCO3)2 harus ditangani dan disimpan dengan hati-hati.
Kegunaan Kalsium Bikarbonat
Berikut beberapa kegunaan umum Ca(HCO3)2:
- Makanan dan Minuman: Digunakan sebagai bahan tambahan makanan dalam produksi makanan panggang tertentu, bahan sisa dan minuman ringan.
- Pengolahan Air: Digunakan untuk meningkatkan alkalinitas air, yang membantu mencegah korosi pipa dan mengurangi keasaman sumber air yang bersifat asam.
- Pertanian: Digunakan sebagai bahan pembenah tanah untuk meningkatkan kandungan kalsium dalam tanah, yang dapat memperbaiki struktur tanah dan pertumbuhan tanaman.
- Obat-obatan: Digunakan dalam beberapa formulasi antasida sebagai zat penetral untuk membantu meredakan mulas dan gangguan pencernaan.
- Konstruksi: Digunakan sebagai sumber kalsium dalam produksi bahan konstruksi tertentu, seperti semen dan plester.
- Pembersihan: Digunakan sebagai bahan abrasif ringan pada beberapa produk pembersih, seperti pasta gigi dan bubuk pembersih.
- Kosmetik: Digunakan sebagai zat penyangga dalam beberapa formulasi kosmetik untuk membantu menjaga pH produk.
Pertanyaan:
T: Apa itu kalsium bikarbonat?
A: Ca(HCO3)2 adalah bubuk kristal putih yang terbentuk ketika kalsium karbonat bereaksi dengan karbon dioksida dan air.
T: Tiga zat apa yang harus berinteraksi untuk membentuk kalsium bikarbonat?
A: Kalsium karbonat, karbon dioksida, dan air harus berinteraksi membentuk Ca(HCO3)2.
T: Apakah kalsium bikarbonat merupakan bahan pengembang?
A: Ya, Ca(HCO3)2 dapat digunakan sebagai bahan sisa dalam pembuatan kue untuk membantu adonan mengembang.
T: Apakah kristal telinga kalsium bikarbonat pernah larut?
A: Ya, kristal Ca(HCO3)2 daun telinga dapat larut dengan sendirinya atau dengan pengobatan, misalnya melalui penggunaan obat atau manuver tertentu.
Q: Berapa jumlah mol atom dalam satu mol Ca(HCO3)2?
A: Ada 10 mol atom dalam satu mol Ca(HCO3)2.
Q: Berapa jumlah atom pada Ca(HCO3)2?
A: Ada total 18 atom dalam Ca(HCO3)2, termasuk 1 atom kalsium, 2 atom karbon, 6 atom hidrogen, dan 9 atom oksigen.
T: Apa itu Ca(HCO3)2?
A: Ca(HCO3)2 adalah rumus kimia kalsium bikarbonat, yaitu senyawa yang terbentuk ketika kalsium karbonat bereaksi dengan karbon dioksida dan air.
