Magnesium iodida adalah senyawa kimia dengan rumus MgI2. Ini adalah padatan kristal putih yang sangat larut dalam air dan alkohol. MgI2 umumnya digunakan sebagai sumber yodium dalam reaksi sintesis organik.
| Nama IUPAC | magnesium iodida |
| Formula molekul | MgI2 |
| nomor CAS | 10377-58-9 |
| Sinonim | Magnesium Diiodida, Magnesium(II) Iodida, UNII-14R347R70C |
| Di ChI | InChI=1S/2HI.Mg/h2*1H;/q;;+2/p-2 |
Sifat magnesium iodida
Rumus Magnesium Iodida
Rumus kimia magnesium iodida adalah MgI2. Rumus ini menunjukkan bahwa molekul magnesium iodida terdiri dari satu kation Mg2+ dan dua anion I-. Rumus magnesium iodida berguna dalam menentukan stoikiometri reaksi kimia dan memprediksi produk reaksi kimia yang melibatkan senyawa tersebut.
Massa Molar Magnesium Iodida
MgI2 memiliki massa molar 278,113 g/mol. Nilai ini diperoleh dengan menambahkan massa atom satu atom Mg (24,305 g/mol) ke massa atom dua atom I (253,808 g/mol) yang ada dalam molekul MgI2. Massa molar MgI2 merupakan parameter penting untuk menentukan massa sejumlah senyawa, berguna dalam banyak aplikasi industri dan ilmiah.
Titik didih magnesium iodida
MgI2 memiliki titik didih yang relatif tinggi yaitu 1309°C. Hal ini menunjukkan bahwa diperlukan sejumlah besar energi untuk memutus gaya tarik menarik antarmolekul antara atom Mg dan I dalam senyawa. Titik didih MgI2 membuatnya cocok untuk aplikasi suhu tinggi, seperti dalam pembuatan semikonduktor dan komponen elektronik lainnya.
Titik Leleh Magnesium Iodida
Titik leleh MgI2 adalah 637°C. Pada suhu ini, MgI2 padat berubah menjadi cair. Titik leleh MgI2 merupakan sifat fisik penting yang menentukan kesesuaiannya untuk berbagai aplikasi. Misalnya, titik leleh yang tinggi menjadikan MgI2 ideal untuk digunakan sebagai fluks dalam produksi paduan aluminium, yang mengharuskan peleburan logam bersama-sama untuk menghasilkan campuran yang homogen.
Massa jenis magnesium iodida g/mL
Massa jenis MgI2 adalah 4,43 g/mL. Nilai ini menunjukkan massa senyawa yang ada dalam volume ruang tertentu. Kepadatan MgI2 merupakan faktor penting untuk dipertimbangkan ketika menentukan jumlah senyawa yang dibutuhkan untuk aplikasi tertentu. Kepadatan MgI2 yang tinggi juga membuatnya berguna sebagai bahan pelindung pada reaktor nuklir.
Berat Molekul Magnesium Iodida
Berat molekul MgI2 adalah 278,113 g/mol. Nilai tersebut merupakan penjumlahan dari berat atom unsur penyusun senyawa, Mg dan I. Berat molekul MgI2 berguna untuk menghitung stoikiometri reaksi kimia dan menentukan jumlah mol senyawa yang ada dalam suatu sampel tertentu.
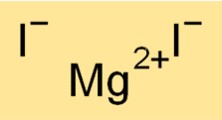
Struktur magnesium iodida
MgI2 memiliki struktur kristal yang termasuk dalam sistem kristal heksagonal. Strukturnya terdiri dari kation magnesium dan anion iodida yang tersusun dalam kisi heksagonal. Kation Mg2+ menempati bagian tengah sel heksagonal, sedangkan anion I- menempati sudut sel. Struktur kristal MgI2 berkontribusi terhadap sifat fisik dan kimianya, seperti titik leleh dan titik didih yang tinggi.
| Penampilan | Padatan kristal putih |
| Berat jenis | 4,43 gram/ml |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 278,113 g/mol |
| Kepadatan | 4,43 gram/ml |
| Titik fusi | 637°C |
| Titik didih | 1.309°C |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Larut |
| Kelarutan | Larut dalam alkohol, aseton |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | Tak dapat diterapkan |
Keamanan dan bahaya magnesium iodida
MgI2 umumnya dianggap aman bila ditangani dan digunakan dengan benar. Namun, seperti senyawa kimia lainnya, bahan ini dapat menimbulkan bahaya tertentu jika tidak ditangani dengan hati-hati. MgI2 diklasifikasikan sebagai bahan pengiritasi kulit dan mata, dan paparan jangka panjang terhadap senyawa tersebut dapat menyebabkan sensitisasi kulit atau iritasi pernafasan. Penting untuk menggunakan alat pelindung diri yang sesuai saat menangani MgI2, termasuk sarung tangan, pelindung mata, dan respirator jika diperlukan. Selain itu, MgI2 dapat bereaksi hebat dengan air, melepaskan gas hidrogen yang mudah terbakar. Oleh karena itu harus disimpan dan ditangani jauh dari sumber kelembapan.
| Simbol bahaya | Xi: Menjengkelkan |
| Deskripsi Keamanan | S22: Jangan menghirup debu. S24: Hindari kontak dengan kulit. S36/37/39: Kenakan pakaian pelindung, sarung tangan, dan pelindung mata/wajah yang sesuai. |
| Nomor identifikasi PBB | UN3077 |
| kode HS | 28276000 |
| Kelas bahaya | 9: Barang-barang berbahaya lainnya |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | Toksisitas rendah |
Metode sintesis magnesium iodida
Ada beberapa metode untuk mensintesis MgI2, masing-masing memiliki kelebihan dan keterbatasan.
Metode yang umum melibatkan reaksi logam magnesium dengan yodium dalam pelarut eter anhidrat atau tetrahidrofuran (THF). Reaksi ini menghasilkan MgI2 berupa endapan padatan berwarna putih.
Metode lain melibatkan reaksi magnesium oksida atau magnesium hidroksida dengan asam hidriodat. Metode ini umumnya melibatkan pemanasan magnesium oksida atau hidroksida dengan asam hidroiodik untuk menghasilkan MgI2.
Reaksi magnesium karbonat atau magnesium oksida dengan gas hidrogen iodida juga menghasilkan MgI2. Reaksi ini umumnya terjadi pada suhu tinggi dan menghasilkan MgI2 berupa produk padatan berwarna putih.
Secara keseluruhan, pilihan metode sintesis MgI2 akan bergantung pada faktor-faktor seperti kemurnian produk akhir yang diinginkan, ketersediaan bahan mentah, dan kondisi di mana sintesis akan dilakukan.
Kegunaan Magnesium Iodida
MgI2 memiliki banyak kegunaan di berbagai bidang karena sifatnya yang unik. Berikut adalah beberapa aplikasi umum MgI2:
- Sebagai katalis: digunakan sebagai katalis dalam reaksi kimia organik, khususnya dalam pembentukan ikatan karbon-karbon.
- Dalam pembuatan reagen Grignard: Digunakan dalam pembuatan reagen Grignard. Ahli kimia organik menggunakan reagen Grignard untuk mensintesis berbagai senyawa organik.
- Secara medis: Digunakan sebagai pengobatan sebagai suplemen untuk menyediakan magnesium dan yodium esensial bagi tubuh, penting untuk menjaga kesehatan fungsi tubuh.
- Dalam reaktor nuklir: digunakan dalam reaktor nuklir sebagai penyerap neutron untuk mengontrol laju reaksi fisi.
- Pemrosesan fotografi: digunakan dalam pemrosesan fotografi sebagai zat penstabil untuk mencegah oksidasi dan degradasi film fotografi.
- Dalam produksi logam magnesium: juga digunakan sebagai prekursor dalam produksi logam magnesium, yang memiliki beragam aplikasi di berbagai industri.
Pertanyaan:
T: Jenis pelarutan apa yang akan dialami MgI2?
J: MgI2 akan mengalami pelarutan ionik karena sifatnya sebagai senyawa ionik.
Q: Apa rumus kimia magnesium iodida?
A: Rumus kimia magnesium iodida adalah MgI2.
T: Apakah MgI2 larut?
A: Ya, MgI2 larut dalam air, alkohol dan eter.
Q: Apa rumus magnesium iodida?
A: Rumus magnesium iodida adalah MgI2.
Q: Jenis senyawa apakah MgI2 itu?
A: MgI2 adalah senyawa ionik yang terbentuk melalui transfer dua elektron dari magnesium ke yodium.
Q: Senyawa apa yang mempunyai rumus kimia MgI2?
A: Senyawa dengan rumus kimia MgI2 adalah magnesium iodida.
Q: Apa nama senyawa yang rumusnya MgI2?
A: Nama senyawa dengan rumus MgI2 adalah Magnesium Iodida.
