Kalsium iodida (CaI2) adalah senyawa kimia yang tersusun dari kalsium dan yodium. Hal ini umumnya digunakan sebagai suplemen yodium dan dalam fotografi sebagai intensifier fotografi.
| Nama IUPAC | Kalsium iodida |
| Formula molekul | CaI2 |
| nomor CAS | 10102-68-8 |
| Sinonim | Kalsium diiodida, Calcii iodidum, Kalsium iodida |
| Di ChI | InChI=1S/Ca.2HI/h;2*1H/q+2;;/p-2 |
Sifat kalsium iodida
Formula Kalsium Iodida
Rumus kimia kalsium iodida adalah CaI2. Hal ini menunjukkan bahwa terdapat dua atom iodium untuk setiap atom kalsium dalam senyawa tersebut. Kalsium iodida adalah padatan kristal putih yang sangat larut dalam air dan pelarut polar lainnya. Ini umumnya digunakan sebagai sumber yodium dalam pakan ternak dan sebagai komponen penguat fotografi.
Massa Molar Kalsium Iodida
CaI2 memiliki massa molar sekitar 293,89 g/mol. Ini dihitung dengan menjumlahkan massa atom Ca (40,08 g/mol) dan I (126,9 g/mol), dikalikan dua, karena ada dua atom I dalam CaI2. Massa molar suatu senyawa merupakan sifat penting yang digunakan dalam perhitungan stoikiometri, yang melibatkan penentuan jumlah reaktan yang dibutuhkan atau jumlah produk yang dihasilkan dalam suatu reaksi kimia.
Titik didih kalsium iodida
Titik didih CaI2 kira-kira 1,327 °C (2,421 °F). Titik didih yang tinggi ini disebabkan oleh kuatnya ikatan ionik antara atom kalsium dan yodium dalam senyawa tersebut. CaI2 umumnya digunakan dalam aplikasi suhu tinggi, seperti dalam produksi paduan dan keramik.
Titik lebur kalsium iodida
CaI2 memiliki titik leleh sekitar 779°C (1.434°F). Tingginya titik leleh CaI2 disebabkan oleh kuatnya ikatan ionik antara atom Ca dan I senyawa tersebut. CaI2 sering digunakan dalam aplikasi suhu tinggi, seperti dalam produksi garam cair dan sebagai fluida perpindahan panas.
Kepadatan kalsium iodida g/mL
Kepadatan CaI2 sekitar 4,51 g/mL. Kepadatan yang tinggi ini disebabkan oleh adanya dua atom I untuk setiap atom Ca dalam senyawa. CaI2 umumnya digunakan sebagai sumber yodium dalam pakan ternak dan sebagai komponen penguat fotografi.
Berat Molekul Kalsium Iodida
Berat molekul CaI2 kira-kira 293,89 g/mol. Ini dihitung dengan menjumlahkan massa atom Ca dan I, dikalikan dua karena ada dua atom I dalam senyawa tersebut. Berat molekul suatu senyawa merupakan sifat penting yang digunakan dalam perhitungan stoikiometri, yang melibatkan penentuan jumlah reaktan yang dibutuhkan atau jumlah produk yang dihasilkan dalam suatu reaksi kimia.
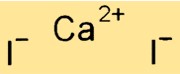
Struktur kalsium iodida
CaI2 memiliki struktur kristal yang mirip dengan natrium klorida (NaCl). Ini membentuk kisi kubik berpusat muka, dengan ion Ca+2 menempati sudut kubus dan ion I- menempati pusat muka. Ikatan ionik yang kuat antara atom Ca dan I dalam senyawa memberikan titik leleh dan titik didih yang tinggi.
| Penampilan | Padatan kristal putih |
| Berat jenis | 4.51 |
| Warna | Tanpa warna |
| Bau | Tidak berbau |
| Masa molar | 293,89 g/mol |
| Kepadatan | 4,51g/ml |
| Titik fusi | 779°C (1.434°F) |
| Titik didih | 1.327°C (2.421°F) |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sangat larut |
| Kelarutan | Larut dalam etanol dan aseton |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | Tak dapat diterapkan |
Keamanan dan Bahaya Kalsium Iodida
CaI2 umumnya dianggap aman dan tidak beracun bila ditangani dan digunakan dengan benar. Namun, jika terkena, bahan ini dapat menyebabkan iritasi pada kulit, mata, dan saluran pernapasan. Menghirup debu CaI2 dapat mengiritasi paru-paru dan tenggorokan. Penting untuk memakai alat pelindung diri yang sesuai, seperti sarung tangan, kacamata dan respirator saat menangani CaI2. CaI2 tidak dianggap mudah terbakar atau meledak, dan tidak diketahui bersifat karsinogenik atau mutagenik. Penting untuk mengikuti prosedur penanganan dan penyimpanan yang benar untuk meminimalkan potensi bahaya.
| Simbol bahaya | Xn,N |
| Deskripsi Keamanan | 26-36/37/39-45-61 |
| Nomor identifikasi PBB | UN3077 |
| kode HS | 28276000 |
| Kelas bahaya | 9 |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | Dapat mengiritasi, berbahaya jika tertelan atau terhirup dan dapat menyebabkan kerusakan organ jika terpapar dalam waktu lama atau berulang-ulang. |
Metode sintesis kalsium iodida
Metode paling umum untuk mensintesis CaI2 adalah dengan mereaksikan asam hidriodat atau yodium dengan kalsium karbonat atau kalsium hidroksida.
Reaksi kalsium karbonat atau kalsium hidroksida dengan asam hidroiodik atau yodium untuk mensintesis CaI2.
Metode kedua melibatkan reaksi kalsium oksida dengan yodium untuk menghasilkan CaI2 dan gas oksigen. Kalsium hidroksida juga dapat melakukan reaksi ini sebagai pengganti kalsium oksida .
Metode lain untuk memproduksi CaI2 melibatkan reaksi logam kalsium dengan yodium. Kalsium bereaksi dengan yodium menghasilkan CaI2 dan melepaskan panas. Kalsium hidrida menggantikan kalsium logam dalam reaksi menghasilkan CaI2.
Reaksi kalsium dengan asam hidriodat dengan adanya zat pereduksi seperti besi atau seng menghasilkan CaI2. Evaporasi larutan untuk mendapatkan kristal CaI2.
Kegunaan Kalsium Iodida
CaI2 memiliki beberapa aplikasi di berbagai industri, antara lain:
- Medis: Digunakan sebagai sumber yodium untuk suplemen makanan dan obat-obatan, seperti hormon tiroid dan radiofarmasi.
- Sintesis kimia: Digunakan sebagai katalis dalam beberapa reaksi kimia, termasuk konversi alkohol menjadi alkil iodida dan dehidrasi metabolit primer menjadi nitril.
- Fotografi: Digunakan dalam produksi film dan kertas fotografi sebagai pemeka terhadap perak bromida dan perak klorida.
- Elektronik: digunakan dalam pembuatan semikonduktor, detektor kilau, dan pelindung radiasi.
- Industri Makanan: Digunakan sebagai bahan tambahan dalam industri makanan untuk menyediakan sumber yodium untuk pengayaan makanan.
- Pakan ternak: Digunakan sebagai suplemen pakan ternak untuk mencegah kekurangan yodium dan meningkatkan kesehatan hewan.
- Industri Minyak dan Gas: Juga digunakan sebagai aditif cairan pengeboran di industri minyak dan gas untuk menstabilkan formasi serpih dan mencegah keruntuhan lubang sumur.
Pertanyaan:
Q: Berapa volume larutan CaI2 0,120 M yang mengandung 0,078 mol zat terlarut?
A: Untuk menghitung volume larutan CaI2 yang mengandung 0,078 mol zat terlarut, kita dapat menggunakan rumus: mol = konsentrasi x volume. Dengan menyusun ulang rumus ini untuk mencari volume, kita mendapatkan volume = mol/konsentrasi. Mengganti nilai yang diberikan dalam soal, kita mendapatkan volume = 0,078 mol / 0,120 M = 0,65 L. Jadi, volume larutan CaI2 yang mengandung 0,078 mol zat terlarut adalah 0,65 L.
Q: Apakah CaI2 larut dalam air?
A: Ya, CaI2 sangat larut dalam air, dengan kelarutan 121 g/100 mL pada 20°C.
Q: Apa nama senyawa yang mempunyai rumus CaI2?
A: Senyawa dengan rumus CaI2 disebut kalsium iodida.
T: Apa itu CaI2?
A: CaI2 adalah senyawa kimia yang tersusun dari kalsium dan yodium. Ini adalah padatan kristal putih atau tidak berwarna yang sangat larut dalam air.
Q: Reaksi apa yang terjadi di anoda selama elektrolisis CaI2?
A: Dalam elektrolisis CaI2, reaksi anodik melibatkan oksidasi ion I- untuk membentuk gas yodium dan elektron. Reaksi keseluruhannya adalah: 2I- -> I2 + 2e-.
Q: Apa rumus kalsium iodida?
A: Rumus kalsium iodida adalah CaI2.
Q: Apakah CaI2 bersifat ionik atau kovalen?
A: CaI2 merupakan senyawa ionik yang terdiri dari kation logam (Ca2+) dan anion nonlogam (I-).
