Kalsium bromida adalah senyawa kimia dengan rumus CaBr2. Ini adalah padatan putih, tidak berbau, larut yang digunakan di berbagai industri sebagai sumber ion bromida.
| Nama IUPAC | Kalsium bromida |
| Formula molekul | CaBr2 |
| nomor CAS | 7789-41-5 |
| Sinonim | Kalsium dibromida; Bromokalsium |
| Di ChI | InChI=1S/Ca.2BrH/jam;2*1H/q+2;;/p-2 |
Sifat kalsium bromida
Formula Kalsium Bromida
Rumus kimia kalsium bromida adalah CaBr2. Rumus ini menunjukkan bahwa ion kalsium terikat pada dua ion bromida melalui ikatan ionik. Rumus suatu senyawa menyatakan jenis dan jumlah atom yang ada dalam suatu molekul atau satuan rumus senyawa tersebut.
Massa Molar Kalsium Bromida
Massa molar CaBr2 adalah 199,89 g/mol. Nilai ini dihitung dengan menjumlahkan massa atom satu atom kalsium (40,08 g/mol) dan dua atom brom (masing-masing 79,90 g/mol). Massa molar adalah sifat penting suatu senyawa kimia karena menentukan jumlah zat yang ada dalam satu mol senyawa.
Titik didih kalsium bromida
Titik didih CaBr2 adalah 1193°C (2179°F). CaBr2 memiliki titik didih yang tinggi karena sifat ioniknya. Senyawa ionik mempunyai gaya elektrostatis yang kuat antara ion-ionnya yang bermuatan positif dan negatif. Gaya-gaya ini memerlukan banyak energi untuk terurai, sehingga menghasilkan titik didih yang tinggi.
Titik leleh kalsium bromida
Titik leleh CaBr2 adalah 730°C (1.346°F). Titik leleh suatu senyawa adalah suhu perubahan wujud padat menjadi cair. CaBr2 memiliki titik leleh yang relatif tinggi karena sifat ioniknya. Gaya elektrostatis yang kuat antar ion-ionnya memerlukan banyak energi untuk mengatasinya, sehingga menghasilkan titik leleh yang tinggi.
Kepadatan kalsium bromida g/mL
Massa jenis CaBr2 adalah 3,353 g/mL. Massa jenis adalah massa suatu zat per satuan volume. Kepadatan CaBr2 yang tinggi disebabkan oleh sifat ioniknya dan susunan ion-ionnya yang rapat.
Berat Molekul Kalsium Bromida
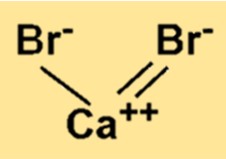
Berat molekul CaBr2 adalah 199,89 g/mol. Nilai ini dihitung dengan menjumlahkan massa atom satu atom kalsium dan dua atom bromin. Berat molekul merupakan sifat penting dari setiap senyawa kimia karena menentukan jumlah zat yang ada dalam molekul senyawa tersebut.
Struktur kalsium bromida
CaBr2 memiliki struktur kisi kristal yang terdiri dari ion Ca2+ dan Br−. Ion Ca2+ dikelilingi oleh enam ion Br−, dan setiap ion Br− dikelilingi oleh enam ion Ca2+. Susunan ion-ion ini menghasilkan ikatan ionik yang kuat di antara keduanya.
| Penampilan | Padatan putih |
| Berat jenis | 3,353 gram/mL |
| Warna | Tanpa warna |
| Bau | Tidak berbau |
| Masa molar | 199,89 g/mol |
| Kepadatan | 3,353 gram/mL |
| Titik fusi | 730°C (1.346°F) |
| Titik didih | 1.193°C (2.179°F) |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sangat larut |
| Kelarutan | Larut dalam alkohol, aseton dan eter |
| Tekanan uap | Tidak tersedia |
| Kepadatan uap | Tidak tersedia |
| pKa | Tak dapat diterapkan |
| pH | 7 (netral) |
Keamanan dan bahaya kalsium bromida
CaBr2 umumnya dianggap aman bila ditangani dengan benar. Namun, hal ini dapat menimbulkan beberapa risiko kesehatan jika tidak ditangani atau digunakan dengan benar. Menghirup atau menelan CaBr2 masing-masing dapat mengiritasi saluran pernapasan dan saluran pencernaan. Kontak kulit yang berkepanjangan dengan CaBr2 dapat menyebabkan iritasi dan dermatitis. CaBr2 juga dapat bereaksi hebat dengan zat pengoksidasi kuat, melepaskan gas beracun. Peralatan pelindung diri yang sesuai, seperti sarung tangan dan kacamata, harus dipakai saat menangani CaBr2. Itu juga harus disimpan di tempat yang sejuk, kering, dan berventilasi baik, jauh dari bahan yang tidak kompatibel.
| Simbol bahaya | Tidak ada |
| Deskripsi Keamanan | Menyebabkan iritasi kulit. Menyebabkan iritasi mata yang serius. Berbahaya jika tertelan atau terhirup. Dapat menyebabkan iritasi pernafasan. |
| Nomor identifikasi PBB | UN3261 |
| kode HS | 28275900 |
| Kelas bahaya | 8 (korosif) |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | Toksisitas rendah hingga sedang. |
Metode sintesis kalsium bromida
Terdapat berbagai metode untuk mensintesis CaBr2, namun yang paling umum melibatkan reaksi antara kalsium karbonat atau kalsium hidroksida dan asam hidrobromat . Proses ini menghasilkan CaBr2 dan air sebagai satu-satunya produk sampingan. Reaksi berlangsung dalam lingkungan terkendali dengan pengadukan dan pemanasan konstan untuk memastikan konversi reaktan secara sempurna.
Metode lain melibatkan reaksi antara kalsium oksida dan asam hidrobromat . Proses ini juga menghasilkan CaBr2 dan air sebagai produk sampingan. Reaksinya mirip dengan metode pertama dan memerlukan pengadukan dan pemanasan yang konstan.
Metode ketiga melibatkan reaksi antara kalsium dan bromin. Reaktivitas brom yang tinggi dan perlunya penanganan yang hati-hati membuat metode ini kurang umum digunakan. Reaksi menghasilkan CaBr2 sebagai satu-satunya produk.
Semua metode ini memerlukan penanganan yang hati-hati dan tindakan pencegahan keselamatan karena melibatkan bahan kimia berbahaya dan reaksi yang berpotensi berbahaya. CaBr2 yang disintesis harus dimurnikan sebelum digunakan untuk menghilangkan kotoran dan memastikan kemurniannya. Kemurnian produk akhir menentukan kualitas dan efektivitasnya untuk tujuan penggunaan.
Kegunaan Kalsium Bromida
CaBr2 menemukan berbagai aplikasi di berbagai industri karena sifat kimianya yang unik. Beberapa kegunaan umum CaBr2 adalah:
- Industri Minyak dan Gas: Digunakan dalam industri minyak dan gas sebagai cairan penyelesaian untuk mengontrol tekanan lubang sumur selama operasi pengeboran dan penyelesaian.
- Kedokteran: Digunakan sebagai obat sebagai obat penenang dan antikonvulsan untuk mengobati epilepsi dan gangguan sistem saraf lainnya.
- Fotografi: Digunakan dalam fotografi sebagai pemeka untuk pembuatan emulsi perak bromida.
- Sintesis kimia: Digunakan sebagai katalis dalam berbagai reaksi kimia, termasuk esterifikasi, alkilasi, dan kondensasi.
- Flame Retardant: Digunakan sebagai penghambat api pada plastik, tekstil, dan bahan lainnya untuk mengurangi risiko kebakaran.
- Industri Makanan: Digunakan sebagai pengawet makanan untuk mencegah pertumbuhan mikroba dan pembusukan.
- Pendinginan: Digunakan sebagai pendingin dalam sistem pendingin absorpsi.
- Pengolahan Air: Digunakan dalam pengolahan air untuk mencegah pertumbuhan alga dan bakteri di kolam renang dan sistem air lainnya.
Pertanyaan:
T: Rumus apa yang mewakili senyawa kalsium bromida?
A: Rumus kimia kalsium bromida adalah CaBr2.
T: Apakah kalsium bromida larut dalam air?
A: Ya, CaBr2 larut dalam air. Ia memiliki kelarutan yang tinggi dalam air, dengan kelarutan sekitar 121 g/100 mL pada 20°C.
T: Apakah kalsium bromida berbentuk air?
A: CaBr2 dapat berada dalam keadaan berair ketika dilarutkan dalam air, membentuk larutan berair.
T: Apakah kalsium bromida dapat larut?
A: Ya, CaBr2 larut dalam berbagai pelarut termasuk air, etanol, dan aseton.
Q: Endapan apa yang terbentuk jika larutan kalsium bromida dan kalium fosfat dicampur?
A: Ketika larutan CaBr2 dan kalium fosfat dalam air dicampur, terbentuk endapan putih kalsium fosfat. Persamaan kimia setara untuk reaksi ini adalah:
CaBr2(aq) + K3PO4(aq) → 2KBr(aq) + Ca3(PO4)2(s)
