Fluoromethane (CH3F) adalah gas tidak berwarna dengan sedikit bau halus. Ini digunakan dalam produksi elektronik, obat-obatan dan sebagai pendingin. Ini tidak terlalu beracun tetapi merupakan gas rumah kaca yang kuat.
| Nama IUPAC | Fluorometana |
| Formula molekul | CH3F |
| nomor CAS | 593-53-3 |
| Sinonim | Metil fluorida, Freon 41, Halocarbon 41, R 41, UN 2452 |
| Di ChI | InChI=1S/CH3F/c1-2/h1H3 |
Sifat fluorometana
CH3F Titik didih
Titik didih CH3F adalah -78,4°C, yang relatif rendah. Hal ini menjadikannya pendingin yang ideal untuk berbagai aplikasi seperti sistem pendingin dan pendingin udara. CH3F juga digunakan sebagai propelan dalam aerosol karena titik didihnya yang rendah.
Massa Molar CH3F
CH3F adalah senyawa kimia dengan rumus molekul CH3F. Ia juga dikenal sebagai metil fluorida dan memiliki massa molar 34,03 g/mol. CH3F adalah gas tidak berwarna dengan sedikit bau halus dan banyak digunakan dalam berbagai aplikasi karena sifatnya yang unik.
CH3F Titik lebur
CH3F memiliki titik leleh -141°C yang juga relatif rendah. Titik lelehnya yang rendah membuatnya mudah untuk ditangani dan diangkut, menjadikannya pilihan populer untuk berbagai aplikasi industri. Titik leleh CH3F yang rendah juga membuatnya cocok untuk digunakan sebagai zat pendingin pada aplikasi suhu rendah.
Kepadatan CH3F
Kepadatan CH3F adalah 0,89 g/ml, yang relatif rendah. Hal ini membuatnya kurang padat dibandingkan udara, yang memiliki massa jenis 1,29 g/ml. Akibatnya, CH3F sering digunakan sebagai gas yang lebih ringan dari udara dalam berbagai aplikasi, termasuk pendeteksi kebocoran, kromatografi gas, dan sebagai gas pengangkat untuk balon dan kapal udara.
Berat Molekul CH3F
Berat molekul CH3F adalah 34,03 g/mol, yang relatif rendah. Hal ini menjadikannya senyawa ringan yang mudah ditangani dan diangkut. CH3F sering digunakan dalam produksi elektronik dan obat-obatan karena berat molekulnya yang rendah dan sifatnya yang unik.
Struktur CH3F
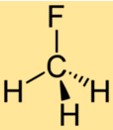
Struktur CH3F terdiri dari satu atom karbon yang terikat pada tiga atom hidrogen dan satu atom fluor. Atom fluor melekat pada atom karbon, menggantikan salah satu atom hidrogen dalam metana. Struktur CH3F menjadikannya senyawa stabil dengan sifat kimia yang unik.
Rumus Fluorometana
Rumus fluorometana adalah CH3F, yang mewakili susunan atom dalam molekul. Rumusnya menunjukkan bahwa fluorometana terdiri dari satu atom karbon, tiga atom hidrogen, dan satu atom fluor. Rumusnya digunakan untuk menggambarkan komposisi kimia fluoromethane dan penting dalam berbagai aplikasi.
| Penampilan | Gas tidak berwarna |
| Berat jenis | 0,89 pada 20°C (udara = 1) |
| Warna | Tanpa warna |
| Bau | Bau halus yang ringan |
| Masa molar | 34,03 g/mol |
| Kepadatan | 0,89g/ml |
| Titik fusi | -141°C |
| Titik didih | -78,4°C |
| Titik kilat | Tidak mudah terbakar |
| Kelarutan dalam air | 0,5 g/L pada 20°C |
| Kelarutan | Dapat larut dalam pelarut organik |
| Tekanan uap | 4,4 bar pada 20°C |
| Kepadatan uap | 1,43 (udara = 1) |
| pKa | 50.9 |
| pH | Tak dapat diterapkan |
Keamanan dan bahaya fluorometana
Fluorometana umumnya dianggap sebagai senyawa yang aman untuk ditangani dan digunakan, rendah toksisitasnya dan tidak mudah terbakar. Namun, seperti bahan kimia lainnya, bahan ini mempunyai potensi bahaya dan pertimbangan keamanan. Paparan fluoromethane konsentrasi tinggi dapat menyebabkan pusing, sakit kepala, dan mual. Ini juga merupakan gas rumah kaca yang berkontribusi terhadap perubahan iklim. Fluorometana harus ditangani di tempat yang berventilasi baik dan peralatan pelindung, seperti sarung tangan dan kacamata, harus dipakai. Penting untuk mengikuti prosedur penyimpanan dan penanganan yang benar untuk menghindari kebocoran dan pelepasan yang tidak disengaja ke lingkungan.
| Simbol bahaya | F+ |
| Deskripsi Keamanan | Gas yang sangat mudah terbakar; Beracun jika terhirup; Menyebabkan iritasi kulit; Menyebabkan iritasi mata yang serius; Dapat menyebabkan kantuk atau pusing; Dapat menyebabkan kerusakan organ |
| Sebuah pengidentifikasi | UN2452 |
| kode HS | 2903.49.90 |
| Kelas bahaya | 2.1 |
| Kelompok pengepakan | II |
| Toksisitas | Toksisitasnya rendah, namun dapat menimbulkan efek kesehatan jika terhirup dalam konsentrasi tinggi. |
Metode sintesis fluorometana
Beberapa metode, termasuk fluorinasi metana langsung dan reaksi pertukaran halogen, dapat mensintesis fluorometana.
Metode yang umum adalah mereaksikan metanol dengan hidrogen fluorida dengan adanya katalis, seperti aluminium oksida atau aluminium fluorida.
Metode lain melibatkan reaksi klorometana atau bromometana dengan gas hidrogen fluorida. Kedua metode ini menghasilkan fluorometana sebagai produk sampingan, yang kemudian dapat dipisahkan dan dimurnikan dengan distilasi atau metode lain.
Metode lain untuk mensintesis fluorometana melibatkan reaksi fluoroform dan hidrogen klorida dengan adanya katalis, seperti seng atau tembaga. Reaksi ini menghasilkan campuran klorofluorometana dan fluorometana, yang dapat dipisahkan dan dimurnikan dengan distilasi.
Kegunaan Fluorometana
Fluoromethane memiliki beberapa kegunaan di berbagai industri, antara lain:
- Pendinginan: Digunakan sebagai pendingin dalam sistem pendingin industri dan komersial karena titik didihnya yang rendah dan tidak mudah terbakar.
- Elektronik: Digunakan sebagai bahan pembersih untuk komponen elektronik dan sebagai bahan pengetsaan plasma dalam industri semikonduktor.
- Aplikasi medis: Digunakan sebagai anestesi dalam kedokteran hewan karena toksisitasnya yang rendah dan tindakannya yang cepat.
- Produksi pestisida: Digunakan sebagai prekursor dalam produksi pestisida tertentu, termasuk herbisida dan insektisida.
- Produksi polimer: digunakan sebagai bahan peniup dalam produksi busa polimer, seperti busa poliuretan.
- Aplikasi Laboratorium: Digunakan sebagai pelarut dan reagen dalam berbagai aplikasi laboratorium, termasuk sintesis dan analisis kimia.
- Pemadam Kebakaran: Juga digunakan sebagai agen pencegah kebakaran pada jenis alat pemadam kebakaran tertentu, khususnya yang digunakan di ruang komputer dan telekomunikasi.
Pertanyaan:
Q: Apakah CH3F polar atau non-polar?
J: CH3F adalah molekul polar karena susunan atom fluor dan hidrogen yang asimetris di sekitar atom karbon pusat, sehingga menghasilkan momen dipol bersih.
Q: Apakah CH3F memiliki ikatan hidrogen?
J: Fluorometana tidak memiliki ikatan hidrogen karena tidak mengandung atom hidrogen yang terikat pada unsur yang sangat elektronegatif seperti nitrogen, oksigen, atau fluor.
Q: Senyawa manakah yang memiliki gaya antarmolekul paling kuat: HF, CH3Cl, CH3F, HCl?
J: HF memiliki gaya antarmolekul terkuat karena kemampuannya membentuk ikatan hidrogen, yang lebih kuat dibandingkan gaya dipol-dipol senyawa lain.
Q: Manakah yang mempunyai gaya dipol-dipol paling lemah: N2, CO, CH3F, HCl?
J: N2 mempunyai gaya dipol-dipol paling rendah karena merupakan molekul non-polar sehingga tidak mempunyai momen dipol neto. CO, CH3F, dan HCl merupakan molekul polar dan memiliki gaya dipol-dipol, namun kekuatan gaya ini meningkat dengan urutan HCl < CH3F < CO karena meningkatnya polaritas molekul.
