Magnesium klorida (MgCl2) adalah senyawa yang tersusun dari ion magnesium dan klorida. Ini biasanya digunakan sebagai suplemen untuk mengobati kekurangan magnesium dan sebagai penghilang es untuk jalan dan trotoar.
| Nama IUPAC | magnesium klorida |
| Formula molekul | MgCl2 |
| nomor CAS | 7786-30-3 |
| Sinonim | Magnesium diklorida, klormagnesit, bisklolomagnesium, magnesium (II) klorida, E511, Nigari |
| Di ChI | InChI=1S/2ClH.Mg/h2*1H;/q;;+2/p-2 |
Formula Magnesium Klorida
Rumus kimia magnesium klorida adalah MgCl2. Rumus ini menunjukkan bahwa magnesium klorida terdiri dari satu ion Mg+2 dan dua ion Cl-. Rumusnya penting dalam menentukan jumlah magnesium klorida yang dibutuhkan untuk reaksi kimia. Magnesium klorida umumnya digunakan sebagai suplemen untuk mengatasi kekurangan magnesium dan sebagai penghilang es untuk jalan dan trotoar.
Massa molar magnesium klorida
Massa molar magnesium klorida adalah 95,21 g/mol. Ini adalah senyawa kristal yang terdiri dari satu ion Mg+2 dan dua ion Cl-. Massa molar merupakan sifat penting magnesium klorida karena digunakan untuk menghitung jumlah zat dalam reaksi kimia. Magnesium klorida umumnya digunakan sebagai suplemen untuk mengatasi kekurangan magnesium dan sebagai penghilang es untuk jalan dan trotoar.
Titik didih MgCl2
MgCl2 memiliki titik didih yang tinggi yaitu 1.412°C yang berarti memerlukan banyak energi untuk memutus ikatan antara atom dan molekulnya. Properti ini membuatnya berguna dalam aplikasi suhu tinggi, seperti dalam produksi logam dan paduan. MgCl2 juga digunakan sebagai pengering untuk menyerap kelembaban dari udara dan sebagai katalis dalam reaksi kimia.
Titik lebur MgCl2
Titik leleh MgCl2 adalah 714°C yang berarti berbentuk padat pada suhu kamar. Sifat ini membuatnya berguna dalam berbagai aplikasi, seperti produksi logam magnesium dan sebagai fluks dalam pengelasan aluminium. MgCl2 juga digunakan sebagai koagulan dalam produksi tahu dan produk kedelai lainnya.
Massa jenis MgCl2 g/ml
Massa jenis MgCl2 adalah 2,32 g/ml. Properti ini membuatnya berguna dalam berbagai aplikasi, seperti produksi bahan tahan api dan pengolahan air limbah. MgCl2 juga digunakan sebagai penekan debu di jalan raya dan konstruksi jalan raya.
Berat molekul MgCl2
Berat molekul MgCl2 adalah 95,21 g/mol. Sifat ini penting untuk menentukan jumlah MgCl2 yang dibutuhkan untuk reaksi kimia. MgCl2 umumnya digunakan sebagai suplemen untuk mengatasi kekurangan magnesium dan sebagai penghilang es untuk jalan dan trotoar.
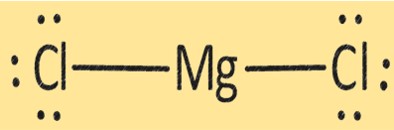
struktur MgCl2
MgCl2 memiliki struktur kristal yang terdiri dari satu ion Mg+2 dan dua ion Cl-. Struktur MgCl2 penting dalam menentukan sifat fisik dan kimianya. MgCl2 digunakan dalam berbagai aplikasi, seperti produksi logam magnesium, sebagai pengering, dan sebagai koagulan dalam produksi tahu dan produk kedelai lainnya.
| Penampilan | Padatan kristal putih |
| Berat jenis | 2,32 gram/ml |
| Warna | Putih |
| Bau | Tidak berbau |
| Masa molar | 95,21 g/mol |
| Kepadatan | 2,32 gram/ml |
| Titik fusi | 714°C |
| Titik didih | 1412°C |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sangat larut |
| Kelarutan | Larut dalam air, etanol, metanol |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | 7.6 (untuk ion Mg(H2O)6^2+) |
| pH | 6.0 – 8.0 |
Keamanan dan bahaya magnesium klorida
Magnesium klorida (MgCl2) umumnya dianggap aman bila digunakan sesuai petunjuk. Namun, hal ini dapat menimbulkan beberapa bahaya jika tidak ditangani dengan benar. Hal ini dapat menyebabkan iritasi pada kulit dan mata, dan menghirup debu dapat menyebabkan masalah pernafasan. Menelan MgCl2 dalam jumlah besar dapat menyebabkan mual, muntah dan diare. Hal ini juga dapat membahayakan kehidupan akuatik jika dilepaskan ke saluran air. Peralatan pelindung yang sesuai, seperti sarung tangan dan kacamata, harus dipakai saat menangani MgCl2. Tumpahan atau pelepasan apa pun harus segera diatasi dan dibersihkan untuk menghindari kerusakan lingkungan.
| Simbol bahaya | Tidak ada yang ditugaskan |
| Deskripsi Keamanan | Hindari kontak dengan kulit dan mata. Jika terkena, bilas dengan air. Kenakan sarung tangan dan kacamata saat menangani. |
| Nomor identifikasi PBB | SATU 2019 |
| kode HS | 28273100 |
| Kelas bahaya | 8 |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | LD50 (lisan, tikus) – 4,640 mg/kg; LC50 (inhalasi, tikus) – >4,4 mg/L selama 4 jam |
Metode Sintesis Magnesium Klorida
Berbagai metode dapat mensintesis MgCl2, antara lain sintesis langsung, reaksi dengan asam klorida , dan reaksi dengan MgO.
Untuk menghasilkan MgCl2 melalui sintesis langsung, bakar logam magnesium di udara atau gas klor untuk menghasilkan MgO. Selanjutnya, reaksikan MgO dengan asam klorida menghasilkan MgCl2:
Mg + O2 → MgO
MgO + 2HCl → MgCl2 + H2O
Metode lain melibatkan mereaksikan logam Mg dengan asam klorida untuk menghasilkan MgCl2 dan gas hidrogen:
Mg + 2HCl → MgCl2 + H2
Untuk reaksi dengan MgO, kami mencampur MgO dengan asam klorida untuk menghasilkan MgCl2 dan air:
MgO + 2HCl → MgCl2 + H2O
Pencampuran MgO dengan asam klorida menghasilkan magnesium klorida dan air ketika bereaksi dengan MgO:
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
Selain itu, kita dapat memperoleh MgCl2 sebagai produk sampingan dari proses Solvay, yang menghasilkan natrium karbonat . Proses tersebut menghasilkan produksi kalsium klorida dan MgCl2 sebagai produk sampingan, yang dapat dipisahkan dari larutan natrium karbonat.
Kegunaan Magnesium Klorida
Magnesium klorida memiliki kegunaan yang luas di berbagai industri, antara lain:
- Agen Deicing: Digunakan sebagai agen deicing di jalan dan trotoar selama bulan-bulan musim dingin karena kemampuannya untuk menurunkan titik beku air.
- Pengendalian Debu: Digunakan sebagai bahan pengendali debu di jalan tak beraspal dan lokasi konstruksi.
- Industri makanan: Digunakan sebagai koagulan dalam produksi tahu dan sebagai sumber magnesium pada produk makanan tertentu.
- Obat: Digunakan sebagai obat sebagai suplemen untuk kekurangan magnesium dan sebagai pengobatan untuk kondisi tertentu, seperti sembelit dan mulas.
- Pertanian: Digunakan sebagai pupuk dan kondisioner tanah untuk meningkatkan kandungan magnesium dalam tanah dan pertumbuhan tanaman.
- Pengolahan Air: Digunakan dalam proses pengolahan air untuk menghilangkan kotoran dan melunakkan air sadah.
- Aplikasi industri: Digunakan dalam produksi tekstil, kertas dan semen, serta dalam berbagai proses industri.
- Kesehatan dan Kesejahteraan: Digunakan dalam berbagai praktik kesehatan dan kebugaran, seperti mandi, untuk meningkatkan relaksasi dan meningkatkan kesehatan kulit.
Pertanyaan:
Q: Apa rumus magnesium klorida?
A: Rumus magnesium klorida adalah MgCl2.
T: Apa itu magnesium klorida?
A: MgCl2 merupakan senyawa anorganik yang umum digunakan di berbagai industri dan aplikasi, termasuk sebagai bahan penghilang lapisan es, bahan pengontrol debu, dan bahan tambahan makanan.
T: Apakah magnesium klorida larut?
A: Ya, MgCl2 larut dalam air dan pelarut polar lainnya.
T: Apakah magnesium klorida bersifat ionik atau kovalen?
A: MgCl2 merupakan senyawa ionik yang terdiri dari kation (Mg2+) dan anion (Cl-).
T: Apa itu MgCl2?
A: MgCl2 adalah rumus kimia magnesium klorida, yang merupakan senyawa anorganik yang digunakan dalam berbagai aplikasi industri dan konsumen.
Q: Apa persamaan ionik bersih untuk reaksi MgCl2 dengan NaOH?
A: Persamaan ionik bersih untuk reaksi MgCl2 dengan NaOH adalah Mg2+ (aq) + 2OH- (aq) → Mg(OH)2 (s).
