Tembaga(I) sulfida (Cu2S) adalah senyawa padat berwarna hitam. Ini digunakan sebagai semikonduktor tipe-P dan katalis dalam berbagai aplikasi industri seperti sel surya dan produksi hidrogen.
| Nama IUPAC | Tembaga sulfida(1+) |
| Formula molekul | Cu2S |
| nomor CAS | 22205-45-4 |
| Sinonim | Tembaga monosulfida, tembaga sulfida, tembaga sulfida (1+), tembaga sulfida, tembaga sulfida, tembaga sulfida |
| Di ChI | InChI=1S/2Cu.S/q2*+1;-2 |
Massa molar tembaga(I) sulfida
Tembaga(I) sulfida memiliki massa molar 159,16 g/mol. Massa molar adalah massa satu mol suatu zat, dihitung dengan menjumlahkan massa atom unsur-unsur yang ada dalam senyawa. Tembaga(I) sulfida terdiri dari dua atom tembaga dan satu atom belerang, masing-masing dengan massa atomnya masing-masing. Mengetahui massa molar penting dalam berbagai perhitungan kimia, seperti menentukan jumlah zat yang dibutuhkan untuk suatu reaksi tertentu atau mencari rumus empiris suatu senyawa.
Titik didih tembaga(I) sulfida
Tembaga(I) sulfida memiliki titik leleh yang tinggi yaitu 1103°C, tetapi tidak memiliki titik didih yang jelas. Hal ini karena ketika dipanaskan pada suhu tinggi, tembaga(I) sulfida terurai bukannya mendidih. Penguraian tembaga(I) sulfida menghasilkan pembentukan gas tembaga dan tembaga sulfida, yang kemudian dapat dikumpulkan dan dianalisis. Kurangnya titik didih tembaga(I) sulfida bukanlah hal yang aneh bagi banyak senyawa padat yang terurai saat dipanaskan.
Titik Leleh Tembaga(I) Sulfida
Tembaga(I) sulfida memiliki titik leleh 1103°C. Titik leleh yang tinggi disebabkan oleh kuatnya ikatan ion antara atom tembaga dan belerang dalam struktur kisi kristal senyawa. Titik leleh tembaga(I) sulfida yang tinggi membuatnya berguna dalam aplikasi suhu tinggi, seperti pada sel surya, yang bertindak sebagai semikonduktor tipe-p.
Massa jenis tembaga(I) sulfida g/ml
Tembaga(I) sulfida memiliki massa jenis 5,6 g/mL. Massa jenis suatu zat adalah massa suatu zat per satuan volume. Kepadatan tembaga(I) sulfida yang tinggi disebabkan oleh atom-atom berat yang ada dalam senyawa, serta struktur kristalnya. Kepadatan tembaga(I) sulfida yang tinggi membuatnya berguna dalam berbagai aplikasi, termasuk sebagai pigmen pada keramik dan kaca.
Berat Molekul Tembaga(I) Sulfida
Berat molekul tembaga(I) sulfida adalah 159,16 g/mol. Berat molekul adalah jumlah berat atom seluruh atom dalam suatu molekul. Tembaga(I) sulfida mempunyai rumus kimia sederhana yang terdiri dari dua atom tembaga dan satu atom belerang, sehingga berat molekulnya relatif mudah untuk dihitung. Berat molekul suatu senyawa penting dalam berbagai perhitungan kimia, seperti menentukan stoikiometri suatu reaksi atau mencari rumus molekul suatu senyawa.
Struktur tembaga(I) sulfida
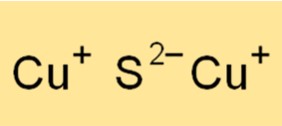
Tembaga(I) sulfida memiliki struktur kisi kristal kubik berpusat muka (fcc). Struktur kristal tersusun atas atom tembaga dan belerang, dengan masing-masing atom tembaga dikelilingi oleh empat atom belerang yang tersusun dalam susunan tetrahedral. Ikatan ionik yang kuat antara atom tembaga dan belerang menghasilkan struktur kristal yang stabil dengan titik leleh yang tinggi. Struktur kristal tembaga(I) sulfida penting untuk memahami sifat fisik dan kimianya, serta berbagai penerapannya.
Rumus Tembaga(I) Sulfida
Rumus kimia tembaga(I) sulfida adalah Cu2S, yang menunjukkan bahwa senyawa tersebut terdiri dari dua atom tembaga dan satu atom belerang. Rumus suatu senyawa memberikan informasi tentang unsur-unsur yang ada dan jumlah atom setiap unsur dalam senyawa tersebut. Rumus tembaga(I) sulfida berguna dalam berbagai perhitungan kimia, seperti menentukan rasio molar tembaga dan belerang dalam suatu senyawa atau mencari rumus empiris senyawa.
| Penampilan | Hitam pekat |
| Berat jenis | 5.6g/ml |
| Warna | Hitam |
| Bau | Tidak berbau |
| Masa molar | 159,16 g/mol |
| Kepadatan | 5.6g/ml |
| Titik fusi | 1103°C |
| Titik didih | Terurai jika dipanaskan |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Tidak larut |
| Kelarutan | Tidak larut dalam air dan pelarut organik |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| pKa | Tak dapat diterapkan |
| pH | Tak dapat diterapkan |
Tembaga (I) sulfida (Cu2S) Keamanan dan bahaya
Tembaga(I) sulfida (Cu2S) umumnya dianggap aman untuk ditangani karena merupakan senyawa padat yang stabil dan tidak reaktif. Namun, seperti semua bahan kimia, bahan ini harus ditangani dengan hati-hati untuk menghindari paparan yang tidak disengaja. Menghirup debu atau uap dari senyawa tersebut harus dihindari, karena dapat menyebabkan iritasi pada sistem pernapasan. Kontak kulit dengan tembaga(I) sulfida (Cu2S) juga dapat menyebabkan iritasi atau reaksi alergi. Inilah sebabnya mengapa sarung tangan dan pakaian pelindung lainnya harus dipakai saat menanganinya. Jika tertelan secara tidak sengaja, perhatian medis harus segera dicari. Prosedur penanganan, penyimpanan dan pembuangan yang benar harus diikuti untuk mencegah bahaya lingkungan.
| Simbol bahaya | Tidak ada |
| Deskripsi Keamanan | Hindari penghirupan dan kontak dengan kulit. Kenakan pakaian pelindung. |
| Nomor identifikasi PBB | Tidak diatur |
| kode HS | 284290 |
| Kelas bahaya | Tidak tergolong berbahaya |
| Kelompok pengepakan | Tak dapat diterapkan |
| Toksisitas | Toksisitas rendah |
Metode sintesis tembaga(I) sulfida (Cu2S)
Ada beberapa metode untuk mensintesis tembaga(I) sulfida (Cu2S), antara lain:
- Metode sintesis langsung: melibatkan mereaksikan bubuk tembaga dengan belerang pada suhu tinggi dalam atmosfer inert untuk membentuk tembaga (I) sulfida.
- Metode solvotermal: Metode ini melibatkan pemanasan campuran tembaga asetat dan tiourea dalam pelarut pada suhu dan tekanan tinggi untuk membentuk partikel tembaga(I) sulfida.
- Metode hidrotermal: Metode ini melibatkan reaksi garam tembaga dan belerang dalam larutan berair pada suhu dan tekanan tinggi untuk membentuk tembaga(I) sulfida.
- Metode pengendapan uap kimia: Metode ini melibatkan penguraian prekursor yang mengandung tembaga dalam lingkungan gas yang mengandung belerang untuk membentuk film tembaga(I) sulfida.
- Metode pirolisis semprot: Ini melibatkan penyemprotan larutan yang mengandung garam tembaga dan belerang ke substrat yang dipanaskan untuk membentuk lapisan tipis tembaga(I) sulfida.
- Metode kopresipitasi: Metode ini melibatkan pengendapan ion tembaga dan belerang secara bersamaan dalam larutan air menggunakan zat pengendap yang sesuai untuk membentuk tembaga(I) sulfida.
- Metode elektrokimia: terdiri dari penggunaan sel elektrokimia untuk menyimpan tembaga (I) sulfida pada substrat dari larutan yang mengandung ion tembaga dan belerang.
Metode ini memberikan tingkat kendali yang berbeda-beda terhadap ukuran, bentuk, dan sifat partikel atau film tembaga(I) sulfida yang dihasilkan, sehingga berguna untuk berbagai aplikasi.
Tembaga(I) sulfida (Cu2S)
Tembaga(I) sulfida (Cu2S) adalah senyawa yang berguna dengan berbagai aplikasi di berbagai bidang. Berikut beberapa kegunaannya:
- Sel fotovoltaik: Digunakan dalam pembuatan sel fotovoltaik. Sel fotovoltaik digunakan untuk menghasilkan listrik.
- Pigmen: Digunakan sebagai pigmen dalam pembuatan berbagai produk, termasuk keramik, kaca, dan plastik. Ini menawarkan warna hitam pekat yang tahan pudar dan pelapukan.
- Pelumas: Digunakan sebagai pelumas dalam berbagai aplikasi karena koefisien gesekannya yang rendah. Ini sangat berguna di lingkungan bersuhu tinggi dan bertekanan tinggi.
- Semikonduktor: Digunakan sebagai bahan semikonduktor dalam aplikasi elektronik dan optoelektronik. Ia memiliki sifat optik dan elektronik unik yang membuatnya cocok untuk berbagai aplikasi, termasuk sel fotovoltaik, sensor, dan detektor.
- Fungisida: Digunakan sebagai fungisida di bidang pertanian untuk melindungi tanaman dari penyakit jamur. Ini adalah alternatif yang efektif dan ekologis dibandingkan fungisida kimia tradisional.
- Pigmen Anorganik: Digunakan dalam pembuatan pigmen anorganik. Pigmen ini digunakan dalam produksi kaca berwarna, keramik, dan enamel. Warna hitam pekatnya tahan terhadap pemudaran dan pelapukan, menjadikannya pilihan populer untuk pigmen yang tahan lama.
Pertanyaan:
T: Apa itu Cu2S?
J: Cu2S adalah rumus kimia untuk tembaga(I) sulfida, senyawa tembaga sulfida yang biasa digunakan dalam berbagai aplikasi termasuk sel fotovoltaik, pigmen, semikonduktor, dan fungisida.
Q: Apa hasil pemanasan campuran Cu2O dan Cu2S?
A: Pemanasan campuran Cu2O dan Cu2S akan menghasilkan campuran gas tembaga dan sulfur dioksida, serta sisa Cu2O atau Cu2S yang tidak bereaksi.
Q: Apa nama senyawa Cu2S? A: Nama senyawa Cu2S adalah tembaga(I) sulfida.
