Aluminium klorida atau AlCl3 merupakan senyawa kimia yang digunakan dalam berbagai proses industri. Ia bertindak sebagai asam Lewis, mengkatalisis sintesis organik dan reaksi polimerisasi. Ia juga memiliki sifat antiperspirant dalam produk perawatan pribadi.
| Nama IUPAC | Aluminium triklorida |
| Formula molekul | AlCl3 |
| nomor CAS | 7446-70-0 |
| Sinonim | Aluminium triklorida, aluminium (III) klorida, aluminium (III) klorida, aluminium klorida, trikloroaluminum |
| Di ChI | InChI=1S/3ClH.Al/h3*1H;/q;;;+3/p-3 |
Formula Aluminium Klorida
Rumus kimia aluminium klorida adalah AlCl3. Rumus ini mewakili jumlah atom setiap unsur dalam molekul. Rumus aluminium klorida penting karena digunakan untuk mengidentifikasi suatu zat dan menghitung sifat-sifatnya. Rumusnya juga digunakan dalam persamaan kimia untuk mewakili reaktan dan produk suatu reaksi kimia.
Massa molar aluminium klorida
Aluminium klorida memiliki massa molar 133,34 g/mol. Nilai ini dihitung dengan menjumlahkan massa atom satu atom aluminium dan tiga atom klor. Rumus molekul aluminium klorida adalah AlCl3, artinya mengandung satu atom aluminium dan tiga atom klor. Massa molar merupakan sifat penting aluminium klorida karena digunakan dalam banyak reaksi kimia dan proses industri. Massa molar juga digunakan untuk menghitung jumlah suatu zat yang ada dalam sampel tertentu.
Titik didih aluminium klorida
Titik didih aluminium klorida adalah 180,8°C (357,4°F). Nilai ini adalah suhu di mana bentuk cair aluminium klorida berubah menjadi gas. Titik didih aluminium klorida relatif tinggi, sehingga berguna dalam banyak proses industri yang memerlukan suhu tinggi. Misalnya, aluminium klorida digunakan sebagai katalis dalam pembuatan polipropilen, suatu polimer termoplastik.
Titik leleh aluminium klorida
Titik leleh aluminium klorida adalah 194°C (381,2°F). Nilai ini adalah suhu di mana bentuk padat aluminium klorida berubah menjadi cair. Titik leleh aluminium klorida relatif rendah sehingga mudah dicairkan dan digunakan dalam berbagai reaksi kimia dan proses industri. Misalnya, aluminium klorida digunakan sebagai koagulan dalam industri pengolahan air.
Massa jenis aluminium klorida g/ml
Massa jenis aluminium klorida adalah 2,44 g/cm3. Nilai ini adalah massa aluminium klorida per satuan volume. Massa jenis aluminium klorida penting karena menentukan massa suatu volume zat tertentu. Massa jenis aluminium klorida juga digunakan untuk menghitung konsentrasi suatu zat dalam suatu larutan.
Struktur aluminium klorida
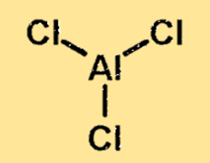
Struktur aluminium klorida adalah molekul yang terikat secara kovalen dengan satu atom aluminium dan tiga atom klor. Atom aluminium terletak di tengah molekul, dikelilingi oleh tiga atom klor. Struktur aluminium klorida penting karena menentukan sifat fisik dan kimia suatu zat.
Berat Molekul Aluminium Klorida
Berat molekul aluminium klorida adalah 133,34 g/mol. Nilai ini merupakan penjumlahan dari berat atom atom-atom dalam molekul. Berat molekul aluminium klorida penting karena digunakan untuk menghitung jumlah suatu zat yang ada dalam sampel tertentu. Nilai ini juga digunakan untuk menentukan konsentrasi molar suatu larutan.
| Penampilan | Padatan atau bubuk berwarna putih hingga kuning |
| Berat jenis | 2,44 gram/cm3 |
| Warna | Tidak berwarna sampai kuning pucat |
| Bau | Tidak berbau |
| Masa molar | 133,34 g/mol |
| Kepadatan | 2,44 gram/cm3 |
| Titik fusi | 194°C (381,2°F) |
| Titik didih | 180,8°C (357,4°F) |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sangat larut dalam air |
| Kelarutan | Larut dalam etanol, metanol dan eter |
| Tekanan uap | 2,67 kPa pada 25°C |
| Kepadatan uap | 4,45 (udara = 1) |
| pKa | -6 |
| pH | 2,0 (10 g/L, H2O) |
Keamanan dan bahaya aluminium klorida
Aluminium klorida menimbulkan beberapa risiko keselamatan dan kesehatan. Bahan ini bersifat korosif dan dapat menyebabkan iritasi parah pada kulit dan mata, serta iritasi saluran pernapasan dan pencernaan jika tertelan atau terhirup. Ini juga dapat menyebabkan luka bakar jika terkena kulit. Aluminium klorida merupakan oksidator kuat dan dapat bereaksi hebat dengan air, melepaskan gas hidrogen klorida. Ia juga tidak kompatibel dengan banyak senyawa organik, seperti alkohol dan amina, dan dapat bereaksi dengannya menghasilkan gas berbahaya. Peralatan pelindung yang sesuai, termasuk sarung tangan, kacamata dan respirator, harus dipakai saat menangani aluminium klorida.
| Simbol bahaya | Korosif, berbahaya |
| Deskripsi Keamanan | Hindari kontak dengan kulit dan mata. Kenakan sarung tangan pelindung dan pelindung mata/wajah. Jika terjadi kontak, bilas dengan banyak air dan konsultasikan dengan dokter. Jangan menelan atau menghirup. Gunakan di area yang berventilasi baik. Simpan di tempat sejuk dan kering, jauh dari bahan yang tidak kompatibel. |
| Nomor identifikasi PBB | PBB 1726 |
| kode HS | 2827.32.00 |
| Kelas bahaya | 8 |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | Beracun jika tertelan atau terhirup. Menyebabkan iritasi kulit dan mata yang serius. Dapat menyebabkan iritasi pada saluran pernapasan dan pencernaan. Dapat bereaksi hebat dengan air, melepaskan gas hidrogen klorida. Tidak kompatibel dengan banyak senyawa organik, seperti alkohol dan amina, dan dapat bereaksi dengannya menghasilkan gas berbahaya. |
Metode sintesis aluminium klorida
Aluminium klorida dapat disintesis dengan berbagai metode seperti sintesis langsung, hidrolisis dan reaksi aluminium dengan hidrogen klorida.
- Sintesis langsung melibatkan reaksi aluminium dengan gas klor pada suhu tinggi, biasanya sekitar 700-800°C. Reaksi aluminium dengan hidrogen klorida menghasilkan aluminium klorida dalam fase gas, yang dapat dikondensasi menjadi bentuk cair.
- Hidrolisis melibatkan reaksi logam aluminium dengan asam klorida atau air, yang menghasilkan gas hidrogen dan aluminium klorida. Reaksi hidrolisis umumnya bersifat eksotermik dan dapat berbahaya jika tidak dilakukan dengan benar.
- Reaksi aluminium dengan gas hidrogen klorida adalah metode lain untuk mensintesis aluminium klorida. Reaksi ini berlangsung pada suhu kamar dan menghasilkan gas hidrogen dan aluminium klorida.
- Metode umum lainnya untuk mensintesis aluminium klorida adalah dengan mereaksikan aluminium oksida dengan asam klorida. Reaksi ini menghasilkan aluminium klorida dan air sebagai produk.
- Mereaksikan aluminium dengan campuran gas klor dan karbon monoksida adalah metode lain untuk mensintesis aluminium klorida. Reaksi ini terjadi pada suhu tinggi dan menghasilkan aluminium klorida dan karbon dioksida.
Secara keseluruhan, sintesis aluminium klorida memerlukan penanganan dan pengendalian kondisi reaksi yang hati-hati untuk memastikan proses yang aman dan efisien.
Kegunaan Aluminium Klorida
Aluminium klorida memiliki banyak kegunaan di berbagai industri karena sifatnya yang unik.
- Reaksi kimia organik, termasuk produksi polimer, obat-obatan, dan parfum, umumnya menggunakan aluminium klorida sebagai katalis.
- Pengolahan air minum dan air limbah untuk menghilangkan padatan tersuspensi sering kali melibatkan penggunaan aluminium klorida sebagai koagulan.
- Produksi aluminium dan paduan mendapat manfaat dari penggunaan aluminium klorida sebagai fluks, yang membantu menghilangkan kotoran dan meningkatkan proses pengecoran.
- Dalam industri petrokimia, aluminium klorida berfungsi sebagai katalis dalam produksi bensin dan hidrokarbon lainnya. Selain itu, digunakan sebagai deodoran dan antiperspiran dalam produk perawatan pribadi.
- Beberapa obat yang dijual bebas menggunakan aluminium klorida, yang memiliki sifat astringen, untuk mengatasi iritasi kulit ringan dan menghentikan pendarahan. Aluminium klorida juga digunakan untuk mengobati hiperhidrosis, suatu kondisi yang ditandai dengan keringat berlebih.
- Industri tekstil menggunakan aluminium klorida sebagai mordan untuk membantu menempelkan pewarna pada kain, dan juga digunakan dalam produksi karet sintetis.
Secara keseluruhan, aluminium klorida memiliki kegunaan yang beragam dan penting di banyak industri, sehingga menyoroti pentingnya aluminium klorida di dunia modern.
Pertanyaan:
T: Manakah yang paling tepat membandingkan 1 mol natrium klorida dengan 1 mol aluminium klorida?
A: 1 mol natrium klorida (NaCl) dan 1 mol aluminium klorida (AlCl3) keduanya mengandung 1 mol ion klorida, namun aluminium klorida mengandung kation tiga kali lebih banyak dibandingkan natrium klorida.
T: Apakah aluminium klorida mengandung air?
A: Aluminium klorida bisa berbentuk padat dan berair. Ketika dilarutkan dalam air, ia membentuk larutan yang sangat asam karena hidrolisis kation aluminium.
Q: Apa rumus aluminium klorida yang benar?
A: Rumus aluminium klorida yang benar adalah AlCl3. Hal ini menunjukkan bahwa setiap molekul aluminium klorida mengandung satu kation aluminium (Al3+) dan tiga anion klorida (Cl-).
T: Apakah aluminium klorida aman?
A: Aluminium klorida bisa berbahaya jika tidak ditangani dengan benar. Ini dapat menyebabkan iritasi kulit dan mata, iritasi saluran pernafasan dan pencernaan dan mungkin beracun jika tertelan atau terhirup. Ini harus disimpan dan ditangani di tempat yang berventilasi baik dan dengan peralatan pelindung yang sesuai.
Q: Berapa banyak ion klorida yang terdapat dalam 1,50 mol aluminium klorida?
A: Karena rumus aluminium klorida adalah AlCl3, setiap molekul mengandung tiga ion klorida. Oleh karena itu, 1,50 mol aluminium klorida mengandung 1,50 x 3 = 4,50 mol ion klorida.
