Amonium klorida atau NH4Cl adalah garam kristal putih yang digunakan dalam berbagai aplikasi, termasuk obat-obatan dan pupuk. Ini dibentuk oleh reaksi amonia dan asam klorida dan memiliki rasa asin yang berbeda.
| Nama IUPAC | Amonium klorida |
| Formula molekul | NH4Cl |
| nomor CAS | 12125-02-9 |
| Sinonim | Sal amonia, Salmiac, garam Nushadir, Amchlor, Sal armagnac, Hidroklorat, Amonium muriate, Sal armagnac |
| Di ChI | InChI=1S/ClH.H3N/h1H;1H3 |
Massa molar NH4Cl
Amonium klorida memiliki massa molar 53,49 g/mol. Massa molar mengacu pada massa satu mol suatu zat dan dinyatakan dalam gram per mol (g/mol). Massa molar amonium klorida ditentukan dengan menjumlahkan massa atom atom penyusunnya, yaitu nitrogen (N), hidrogen (H), dan klor (Cl). Rumus molekul amonium klorida adalah NH4Cl yang artinya mengandung satu atom nitrogen, empat atom hidrogen, dan satu atom klor. Oleh karena itu, massa molar amonium klorida dapat dihitung sebagai berikut
Massa molar = (1 x massa atom N) + (4 x massa atom H) + (1 x massa atom Cl)
= (1 x 14,01 g/mol) + (4 x 1,01 g/mol) + (1 x 35,45 g/mol)
= 53,49 g/mol
Titik didih amonium klorida
Titik didih amonium klorida adalah 520°C (968°F). Titik didih adalah suhu di mana tekanan uap suatu cairan sama dengan tekanan eksternal yang diberikan padanya. Pada suhu ini, amonium klorida menguap dan berubah menjadi gas. Tingginya titik didih amonium klorida disebabkan oleh ikatan ionik yang kuat antara ion amonium (NH4+) dan klorida (Cl-).
Titik leleh amonium klorida
Titik leleh amonium klorida adalah 338°C (640°F). Titik leleh adalah suhu di mana zat padat berubah menjadi cair. Pada suhu ini, ikatan ion antara ion amonium (NH4+) dan klorida (Cl-) terputus dan amonium klorida berubah dari padat menjadi cair. Amonium klorida memiliki titik leleh yang relatif rendah dibandingkan senyawa ionik lainnya, sehingga berguna dalam aplikasi tertentu seperti pengelasan dan metalurgi.
Massa jenis amonium klorida g/ml
Massa jenis amonium klorida adalah 1,527 g/cm³. Massa jenis adalah ukuran jumlah massa per satuan volume suatu zat. Kepadatan amonium klorida yang tinggi disebabkan oleh struktur kisi ioniknya yang sangat kompak. Amonium klorida memiliki massa jenis yang lebih tinggi dibandingkan air sehingga akan tenggelam dalam air.
Berat molekul amonium klorida
Berat molekul amonium klorida adalah 53,49 g/mol. Berat molekul adalah jumlah berat atom seluruh atom dalam suatu molekul. Berat molekul amonium klorida sama dengan massa molarnya.
Struktur amonium klorida
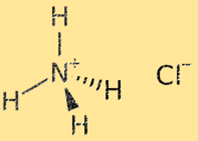
Struktur amonium klorida adalah kisi kristal yang terdiri dari ion amonium (NH4+) dan klorida (Cl-) yang berselang-seling. Ion amonium merupakan ion poliatomik bermuatan positif (+1), terdiri dari satu atom nitrogen dan empat atom hidrogen. Ion klorida adalah ion monatomik bermuatan negatif (-1), terdiri dari atom klor. Struktur kisi kristal amonium klorida distabilkan oleh ikatan ionik yang kuat antara ion amonium dan klorida, menghasilkan padatan yang sangat stabil dan rapuh.
Rumus Amonium Klorida
Rumus amonium klorida adalah NH4Cl. Ini terdiri dari ion amonium (NH4+) dan ion klorida (Cl-). Rumusnya mewakili rasio atom dalam suatu molekul dan menunjukkan bahwa untuk setiap ion amonium, terdapat satu ion klorida. Rumus amonium klorida digunakan untuk menentukan massa molar, massa jenis, dan sifat-sifat senyawa lainnya.
| Penampilan | Padatan kristal putih |
| Berat jenis | 1,527 gram/cm³ |
| Warna | Tidak berwarna sampai putih |
| Bau | Tidak berbau |
| Masa molar | 53,49 g/mol |
| Kepadatan | 1,527 gram/cm³ |
| Titik fusi | 338°C (640°F) |
| Titik didih | 520°C (968°F) |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | 29,7g/100ml (25°C) |
| Kelarutan | Larut dalam etanol dan aseton |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| PKa | 09:25 |
| pH | 4.6 (larutan 5%) |
Keamanan dan bahaya amonium klorida
Amonium klorida (NH4Cl) umumnya dianggap aman untuk penggunaan normal. Namun, bisa berbahaya jika tertelan atau terhirup dalam jumlah banyak. Menelan NH4Cl dapat menyebabkan iritasi mulut dan tenggorokan, mual, muntah dan diare. Menghirup NH4Cl dapat menyebabkan iritasi sistem pernafasan, batuk dan sesak nafas. NH4Cl harus ditangani dengan hati-hati karena dapat menyebabkan iritasi kulit dan mata. Penting juga untuk menghindari paparan debu atau uap NH4Cl, yang dapat mengiritasi mata, hidung, dan tenggorokan. Peralatan pelindung diri yang sesuai, seperti sarung tangan dan kacamata, harus dipakai saat menangani NH4Cl.
| Simbol bahaya | XI |
| Deskripsi Keamanan | S22, S24/25, S36/37/39 |
| Nomor identifikasi PBB | PBB 3077 |
| kode HS | 2827.10.00 |
| Kelas bahaya | 9 – Barang berbahaya lainnya |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | Toksisitas rendah, namun mungkin berbahaya jika tertelan atau terhirup dalam jumlah banyak. |
Metode sintesis amonium klorida
Amonium klorida (NH4Cl) dapat disintesis dengan berbagai metode.
- Metode yang umum adalah mereaksikan gas amonia dengan asam klorida dalam air. Reaksi eksotermik ini menghasilkan NH4Cl dalam bentuk padatan kristal putih. Penting untuk menambahkan asam klorida ke dalam air secara perlahan sambil diaduk untuk menghindari percikan akibat panas yang dihasilkan.
- Metode lain untuk memproduksi NH4Cl adalah sebagai produk sampingan dari berbagai proses industri seperti produksi natrium karbonat atau proses Solvay.
- Cara lain untuk mensintesis NH4Cl adalah dengan mereaksikan amonia dengan natrium klorida. Reaksi ini menghasilkan NH4Cl dan natrium hidroksida. Reaksi ini bersifat eksotermik dan memerlukan pengendalian yang cermat untuk menghindari pembentukan produk sampingan yang tidak diinginkan.
Kegunaan Amonium Klorida
Amonium klorida (NH4Cl) memiliki banyak kegunaan di berbagai industri.
- NH4Cl berfungsi sebagai pupuk di bidang pertanian, menyediakan nutrisi penting bagi tanaman seperti nitrogen dan klorida, sehingga meningkatkan hasil dan kualitas.
- Amonium klorida memfasilitasi berfungsinya sel kering dengan menghantarkan listrik sebagai elektrolit.
- Industri tekstil menggunakan NH4Cl sebagai zat pewarna dan pencetakan, yang membantu memperbaiki pewarna pada kain dan meningkatkan tahan luntur warna.
- Sebagai fluks dalam pengerjaan logam dan penyolderan, NH4Cl menghilangkan lapisan oksida dari logam, sehingga memudahkan pengelasan.
- Bahan kimia ini mempunyai aplikasi dalam makanan, obat-obatan dan kosmetik sebagai bahan penyedap, ekspektoran dalam obat batuk dan bahan dalam produk perawatan pribadi.
Secara keseluruhan, sifat unik NH4Cl menjadikannya bahan kimia serbaguna dengan banyak aplikasi penting di berbagai industri.
Pertanyaan:
T: Apakah amonium klorida bersifat sublim?
J: Ya, amonium klorida diketahui dapat menyublim, artinya ia dapat berpindah langsung dari fase padat ke fase gas tanpa meleleh di antara fase tersebut.
Q: Apakah NH4Cl bersifat asam atau basa?
A: Amonium klorida adalah garam asam. Ketika dilarutkan dalam air, ia dapat mengalami hidrolisis menghasilkan larutan asam. Hal ini karena ion amonium bertindak sebagai asam lemah dan menyumbangkan proton (H+) ke molekul air.
Q: Apa rumus amonium klorida?
A: Rumus amonium klorida adalah NH4Cl. Ini terdiri dari ion amonium (NH4+) dan ion klorida (Cl-) yang disatukan oleh ikatan ionik.
Q: Apakah amonium klorida larut dalam air?
A: Ya, amonium klorida sangat larut dalam air. Pada suhu kamar, kurang lebih 29,7 gram amonium klorida dapat larut dalam 100 mililiter air.
Q: Bagaimana cara memisahkan amonium klorida dan natrium klorida?
J: Salah satu cara untuk memisahkan amonium klorida dan natrium klorida adalah sublimasi. Hal ini dapat dicapai dengan memanaskan campuran, menyebabkan amonium klorida menyublim sedangkan natrium klorida tetap dalam bentuk padat. Amonium klorida yang disublimasikan kemudian dapat dikumpulkan dan dikondensasi kembali menjadi bentuk padat. Cara lain adalah dengan melarutkan campuran dalam air dan kemudian secara selektif mengendapkan salah satu garam menggunakan reagen tertentu atau penyesuaian pH.
