Natrium fosfat dibasa atau Na2HPO4 merupakan senyawa yang biasa digunakan sebagai zat penyangga di laboratorium. Hal ini juga dapat ditemukan di beberapa produk makanan dan minuman sebagai bahan tambahan makanan.
| Nama IUPAC | Dinatrium hidrogen fosfat |
| Formula molekul | Na2HPO4 |
| nomor CAS | 7558-79-4 |
| Sinonim | Natrium hidrogen fosfat, Dinatrium fosfat, Natrium fosfat dibasa, Natrium fosfat dibasa anhidrat, Natrium fosfat dibasa heptahidrat |
| Di ChI | InChI=1S/2Na.H3O4P/c;;1-5(2,3)4/jam;;(H3,1,2,3,4)/q2*+1;/p-2 |
massa molar Na2HPO4
Massa molar natrium fosfat dibasa adalah 141,96 g/mol. Nilai ini dihitung dengan menjumlahkan massa atom masing-masing unsur yang ada dalam senyawa, yaitu natrium (Na), fosfor (P) dan oksigen (O). Massa molar merupakan parameter penting yang digunakan dalam berbagai perhitungan, misalnya untuk menentukan jumlah suatu zat yang diperlukan untuk melakukan reaksi atau untuk menyiapkan larutan dengan konsentrasi tertentu.
Formula Dinatrium Fosfat
Rumus kimia natrium fosfat dibasa adalah Na2HPO4. Rumus ini mewakili rasio masing-masing unsur yang ada dalam senyawa. Rumusnya penting dalam menentukan sifat kimia suatu senyawa, seperti reaktivitas dan kelarutannya.
Titik didih dibasa natrium fosfat
Natrium fosfat dibasa tidak memiliki titik didih tertentu karena terurai sebelum mencapai titik didihnya. Namun, suhu penguraian natrium fosfat dibasa adalah sekitar 155°C. Pada suhu di atas nilai ini, senyawa mulai terurai menjadi ion-ion penyusunnya, natrium dan fosfat. Properti ini membuatnya tidak cocok untuk digunakan dalam aplikasi yang memerlukan pemanasan hingga suhu tinggi.
Titik lebur natrium fosfat dibasa
Titik leleh Na2HPO4 bervariasi tergantung pada bentuk keberadaannya. Bentuk senyawa anhidrat memiliki titik leleh 358°C, sedangkan bentuk heptahidrat memiliki titik leleh lebih rendah yaitu 93°C. Titik leleh adalah sifat fisik penting yang digunakan untuk mengidentifikasi dan mengkarakterisasi suatu zat.
Kepadatan dibasa natrium fosfat g/ml
Kepadatan Na2HPO4 tergantung pada bentuk keberadaannya. Bentuk senyawa anhidrat memiliki massa jenis 1,7 g/mL, sedangkan bentuk heptahidrat memiliki massa jenis lebih rendah yaitu 1,68 g/mL. Massa jenis adalah suatu sifat fisika yang menggambarkan banyaknya massa yang terkandung dalam volume tertentu suatu zat.
Berat Molekul Dibasa Natrium Fosfat
Berat molekul Na2HPO4 adalah 141,96 g/mol. Nilai ini dihitung dengan menjumlahkan massa atom masing-masing unsur yang ada dalam senyawa. Berat molekul merupakan parameter penting yang digunakan dalam berbagai perhitungan, misalnya untuk menentukan jumlah suatu zat yang dibutuhkan untuk melakukan suatu reaksi atau untuk membuat larutan dengan konsentrasi tertentu.
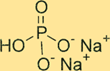
Struktur dibasa natrium fosfat
Na2HPO4 memiliki struktur kristal. Bentuk senyawa anhidrat berupa bubuk putih tidak berbau, sedangkan bentuk heptahidrat berupa kristal transparan tidak berwarna. Senyawa tersebut mempunyai bentuk tetrahedral di sekeliling atom fosfor, dengan masing-masing atom oksigen terletak di sudut tetrahedron. Ion natrium terletak di ruang interstisial antara tetrahedra.
| Penampilan | Bubuk putih atau kristal transparan |
| Berat jenis | 1,68 – 1,7 gram/mL |
| Warna | Tidak berwarna sampai putih |
| Bau | Tidak berbau |
| Masa molar | 141,96 g/mol |
| Kepadatan | 1,68 – 1,7 gram/mL |
| Titik fusi | Anhidrat: 358°C, Heptahidrat: 93°C |
| Titik didih | Rusak sebelum direbus |
| Titik kilat | Tak dapat diterapkan |
| Kelarutan dalam air | Sangat larut |
| Kelarutan | Larut dalam air, tidak larut dalam etanol |
| Tekanan uap | Tak dapat diterapkan |
| Kepadatan uap | Tak dapat diterapkan |
| PKa | 2.15 (ion fosfat) |
| PH | 8.0 – 11.0 (larutan berair 0,1 M) |
Keamanan dan Bahaya Natrium Fosfat Dibasic
Natrium fosfat dibasa (Na2HPO4) umumnya dianggap aman untuk digunakan dalam berbagai aplikasi, namun dapat menyebabkan iritasi kulit dan mata. Menghirup senyawa dalam bentuk bubuk dapat menyebabkan iritasi pernafasan. Na2HPO4 dapat bereaksi hebat dengan asam kuat dan zat pengoksidasi, serta dapat melepaskan asap beracun bila dipanaskan pada suhu tinggi. Seperti semua bahan kimia, tindakan pencegahan yang tepat harus dilakukan saat menangani senyawa ini, seperti mengenakan pakaian pelindung dan sarung tangan serta bekerja di area yang berventilasi baik. Jika kena kulit atau mata, bilas dengan banyak air dan konsultasikan dengan dokter jika perlu.
| Simbol bahaya | Tidak ada |
| Deskripsi Keamanan | S22 – Jangan menghirup debu, S24 – Hindari kontak dengan kulit, S37 – Gunakan sarung tangan yang sesuai |
| Sebuah pengidentifikasi | UN3077 |
| kode HS | 28352200 |
| Kelas bahaya | 9 |
| Kelompok pengepakan | AKU AKU AKU |
| Toksisitas | LD50 (tikus, oral) – 3,400 mg/kg |
Metode sintesis natrium fosfat dibasa
Natrium fosfat dibasa (Na2HPO4) dapat disintesis dengan beberapa metode, antara lain reaksi asam fosfat dengan natrium hidroksida, netralisasi asam fosfat dengan natrium karbonat atau bikarbonat, dan reaksi natrium fosfat monobasa dengan natrium hidroksida.
- Metode yang umum adalah mereaksikan asam fosfat dengan natrium hidroksida dengan perbandingan 1:2 untuk menghasilkan Na2HPO4 dan air. Reaksi dapat dilakukan pada suhu kamar atau dengan pemanasan lembut, dan produk yang dihasilkan dimurnikan dengan kristalisasi atau penguapan.
- Cara lain adalah dengan menetralkan asam fosfat dengan natrium karbonat atau bikarbonat, diikuti dengan pengendapan Na2HPO4. PH campuran reaksi diatur menjadi sekitar 8-9 menggunakan natrium karbonat atau bikarbonat, dan endapan yang dihasilkan dikumpulkan dan dicuci dengan air untuk menghilangkan kotoran.
- Metode ketiga melibatkan mereaksikan natrium fosfat monobasa dengan natrium hidroksida dengan perbandingan 1:1, menghasilkan pembentukan Na2HPO4 dan air. Produk yang dihasilkan kemudian dimurnikan dengan kristalisasi atau penguapan.
Pilihan metode tergantung pada faktor-faktor seperti kemurnian yang diinginkan, hasil dan efektivitas biaya. Sintesis Na2HPO4 dapat dilakukan dengan beberapa metode yang masing-masing mempunyai kelebihan dan keterbatasan.
Kegunaan natrium fosfat dibasa
Natrium fosfat dibasa memiliki banyak aplikasi di berbagai industri.
- Industri makanan menggunakannya sebagai pengemulsi, penyangga dan zat pengental. Ia bertindak sebagai sekuestran, membantu menjaga kualitas dan stabilitas makanan dengan mencegah ion logam bereaksi dengan komponen makanan lainnya. Ini berfungsi sebagai bahan pembersih dalam baking powder dan sebagai pengatur pH dalam produk susu.
- Industri medis menggunakannya sebagai obat pencahar untuk mengobati sembelit dengan meningkatkan kandungan air di usus besar. Ini juga digunakan dalam persiapan obat-obatan dan suntikan sebagai pengatur pH dan penyangga.
- Dalam industri pertanian, ia bertindak sebagai pupuk, menyediakan fosfor bagi tanaman.
- Ini juga berfungsi sebagai suplemen nutrisi dalam pakan ternak.
- Industri pengolahan air menggunakan Na2HPO4 sebagai penghambat korosi dan penghambat kerak pada boiler dan sistem pendingin.
- Ia bertindak sebagai bahan pembersih, menghilangkan endapan kalsium dan magnesium dari permukaan.
Pertanyaan:
Q: Apakah natrium fosfat dibasic merupakan bahan pengawet?
A: Na2HPO4 umumnya tidak digunakan sebagai bahan pengawet pada produk makanan. Namun, ia dapat bertindak sebagai sequestrant, yang dapat membantu menjaga kualitas dan stabilitas makanan dengan mencegah ion logam bereaksi dengan komponen makanan lainnya.
Q: Berapa mol natrium fosfat dibasa (mw 141,98) dalam 50 ml larutan 20% b/v?
A: Untuk menghitung jumlah mol dalam larutan Na2HPO4 20% b/v, pertama-tama kita perlu mengubah persentase berat/volume menjadi gram/100 ml. Larutan 20% b/v berarti 20 gram senyawa dalam 100 ml larutan. Jadi, 50 ml larutan mengandung 10 gram Na2HPO4. Untuk menghitung jumlah mol, bagi massa dengan berat molekul:
mol = massa / berat molekul mol = 10 g / 141,98 g/mol mol = 0,070 mol
Oleh karena itu, terdapat 0,070 mol Na2HPO4 dalam 50 ml larutan 20% b/v.
T: Berapa massa jenis natrium fosfat dibasa?
A: Massa jenis Na2HPO4 bergantung pada bentuk dan konsentrasi senyawa. Bentuk anhidrat memiliki kepadatan sekitar 2,36 g/cm³, sedangkan bentuk heptahidrat memiliki kepadatan sekitar 1,62 g/cm³. Dalam larutan, massa jenisnya akan bervariasi tergantung konsentrasinya.
